大气中的部分碘源于O3对海水中I¯的氧化。某科学小组进行O3与含I¯溶液反应的相关研究。
(1)O3将I¯氧化生成I2的过程由3步反应组成:
① I¯(aq)+ O3(g)="==" IO¯(aq)+O2(g) △H1
② IO¯(aq)+H+(aq) HOI(aq) △H2
HOI(aq) △H2
③ HOI(aq) + I¯(aq) + H+(aq) I2(aq) + H2O(l) △H3
I2(aq) + H2O(l) △H3
用热化学方程式表示O3氧化I¯生成I2的反应____________________。
(2)O3在水中易分解,一定条件下,O3的浓度减少一半时所需的时间(t)如下表所示。已知:O3的起始浓度为0.0216 mol/L。
 |
3.0 |
4.0 |
5.0 |
6.0 |
| 20 |
301 |
231 |
169 |
58 |
| 30 |
158 |
108 |
48 |
15 |
| 50 |
31 |
26 |
15 |
7 |
① 在30℃、pH=4.0条件下,O3的分解速率为__________mol/(L·min)。
② pH增大能加速O3分解,表明对O3分解起催化作用的是___________。
③ 根据表中数据,推测O3在下列条件下分解速率依次增大的顺序为_________(填字母代号)。
a.40℃、pH=3.0 b.10℃、pH=4.0 c.30℃、pH=7.0
(3)I2在KI溶液中存在下列平衡:I2(aq)+I-(aq) I3-(aq)。测得不同温度下该反应的平衡常数如图1所示,下列说法正确的是_____________。
I3-(aq)。测得不同温度下该反应的平衡常数如图1所示,下列说法正确的是_____________。
A.反应I2(aq)+I-(aq)  I3-(aq)的ΔH>0
I3-(aq)的ΔH>0
B.利用该反应可以除去硫粉中少量的碘单质
C.在上述平衡体系中加入苯,平衡不移动
D.25℃时,在上述平衡体系中加入少量KI固体,平衡常数K小于680


图1 图2
(4)将I2溶于CCl4中,得到紫红色的溶液,再加入一定浓度的KI溶液,现象如图2所示:
①上层溶液中含碘元素的微粒有____________________(用化学符号表示)。
②由实验现象可推测关于I2溶解性的结论是_________________________。
某二元醇A,含氧的质量分数为27.1%,其余是碳和氢。A有如下图转化关系,在转化的过程中碳原子的连接方式可能会发生变化,A、B、C、D分子结构中都有4个甲基 ,且均为链状结构。(已知有机物中同一个碳上连接两个羟基不稳定)
,且均为链状结构。(已知有机物中同一个碳上连接两个羟基不稳定)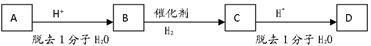
|
(1)A的相对分子质量是_________
(2)A和D的结构简式分别是________________和______ _________________
_________________
现有四种系列同族元素形成的物质,它们的沸点(℃,P=1.01×105Pa)如下表所示,
| ① |
He-268.8 |
Ne-249.5 |
Ar(x) |
Kr-151.7 |
| ② |
F2-187.0 |
Cl2-33.6 |
(a) 58.7 |
I2 184.0 |
| ③ |
HF(y) |
HCl-84.0 |
HBr-67.0 |
HI-35.3 |
| ④ |
H2O(z) |
H2S-60.2 |
(b)-42.0 |
H2Te-1.8 |
试根据上表回答下列问题
(1)a为____________色液体;b的分子式为_______________。
(2)写出②系列中物质主要化学性质的递变规律(任写一种)_______ _____
____________________;能够说明该递变规律的化学事实是_________________________
(任举一例,用离子方程式表示)。
3)除极少数情况外,上述四种系列中物质的沸点与相对分子质量之间均存在一定的关系,该关系是___________________________________________________________________。
(4)上表中,______和______两种物质的沸点较同系 列其它物质反常,反常的主要原因是__
列其它物质反常,反常的主要原因是__
___________________________________________________________________________。
1919年,Langmuir提出:原子数相同、电子数相同的分子,互称为等电子体。等电子体的结构相似、物理性质相近,称为等电子原理。后来,该原理被推广使用于一些具有特殊功能的晶体的发现和人工合成等诸多领域。如:X是一种新型无机材料,它与碳化硅(SiC)结构相似、物理性质相近,符合该原理。X有如下的转变:其中:C是一种能使湿润的红色石蕊试纸变蓝的无色气体,D为白色沉淀,E溶液的焰色反应中火焰呈黄色。回答以下问题: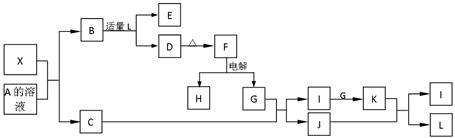
(1)写出X的化学式:__________,X属于__________ 晶体(填“原子”、“分子”或“离子”)。
晶体(填“原子”、“分子”或“离子”)。
(2)写出X与A溶液反应的化学方程式:_____________________________________。
写出K与J反应的化学方程式:_____________________________________。
(3)若B中加入足量的L,则不能生成D物质,请用离子方程式表示其原因:
。
(4)X与SiC的复合粉末是新一代大规模集成电路的理想散热材料。最近日本科学家研究出一种新物质与氮气制备该纳米级复合材料的方法,请将该反应补充完整(方框中填新物质的化学式)。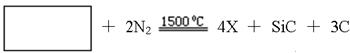 。
。
科学家从化肥厂生产的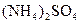 中检出组成为
中检出组成为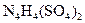 的物质,经测定,该物质易溶于水,在水中以
的物质,经测定,该物质易溶于水,在水中以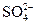 和
和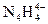 两种离子形式存在,植物的根系极易吸收
两种离子形式存在,植物的根系极易吸收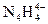 ,但它遇到碱时,会生成一种形似白磷的N4分子,N4分子不能被植物吸收。
,但它遇到碱时,会生成一种形似白磷的N4分子,N4分子不能被植物吸收。
请回答下列问题:
(1)N4和N2的关系正确的是______________(填序号)
| A.同种单质 | B.同位素 | C.同分异构体 | D.同素异形体 |
(2)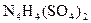 ______________(填“能”或“不能”)和草木灰混合施用:
______________(填“能”或“不能”)和草木灰混合施用:
(3)已知白磷、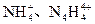 的空间构型均为四面体,
的空间构型均为四面体,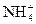 的结构式为
的结构式为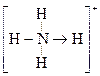 (
(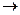 表示共用电子对由N原子单方面提供),白磷(P4)的结构式为
表示共用电子对由N原子单方面提供),白磷(P4)的结构式为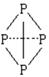
请画出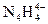 的结构式____________________________________;
的结构式____________________________________;
(4)已知液氨中存在着平衡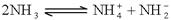 。科学家在液氨中加入氢氧化铯(CsOH)和特殊的吸水剂,使液氨中的
。科学家在液氨中加入氢氧化铯(CsOH)和特殊的吸水剂,使液氨中的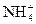 生成N4分子,请写出液氨与氢氧化铯反应的化学方程式:_____________________________________________;
生成N4分子,请写出液氨与氢氧化铯反应的化学方程式:_____________________________________________;
(5)含有一定量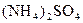 和NH3·H2O的水溶液称为“缓冲溶液”,在此溶液中加入少量的强碱或强酸时,溶液的pH几乎不变,这可由下列离子方程式来说明。
和NH3·H2O的水溶液称为“缓冲溶液”,在此溶液中加入少量的强碱或强酸时,溶液的pH几乎不变,这可由下列离子方程式来说明。
加酸时: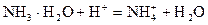
加碱时: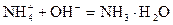
由于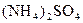 和
和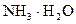 的大量存在,加少量酸或碱时,溶液中
的大量存在,加少量酸或碱时,溶液中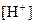 与
与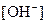 基本保持不变;
基本保持不变;
含有一定量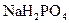 和
和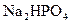 的溶液,也具有缓冲作用,写出此溶液中加入少量强酸或强碱时发生的离子反应方程式:
的溶液,也具有缓冲作用,写出此溶液中加入少量强酸或强碱时发生的离子反应方程式:
加酸时_____________________________________________;
加碱时_____________________________________________。
哈尔滨市场销售的某种食用精制盐包装袋上有如下说明:
| 产品标准 |
GB5461 |
| 产品等级 |
一级 |
| 配料 |
食盐、碘酸钾、抗结剂 |
| 碘含量(以I计) |
20~50 mg/kg |
| 分装日期 |
|
| 分装企业 |
(1)碘酸钾与碘化钾在酸性条件下发生如下反应,配平化学方程式(将化学计量数填于空白处):
___KIO3+___KI+___H2SO4 =___K2SO4+___I2+___H2O
(2)上述反应生成的I2可用四氯化碳检验。向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳。
①Na2SO3稀溶液与I2反应的离子方程式是。
②某学生设计回收四氯化碳的操作步骤为:
a.将碘的四氯化碳溶液置于分液漏斗中;
b.加入适量Na2SO3稀溶液;
c.分离出下层液体。
以上设计中遗漏的操作及上述步骤中的位置是_________________________________。
(3)已知:I2+2S2O32- = 2I-+S4O62-。某学生测定食用精制盐的碘含量,其步骤为:
a.准确称取w g食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉溶液为指示剂,逐滴加入物质的量浓度为2.0×10-3 mol/L的Na2S2O3溶液
10.0 mL,恰好反应完全。
①判断c中反应恰好完全依据的现象是。
②b中反应所产生的I2的物质的量是mol。
③根据以上实验和包装袋说明,所测精制盐的碘含量是(以含w的代数式表示)
_________________mg/kg。