氮的固定是几百年来科学家一直研究的课题。
(1)下表列举了不同温度下大气固氮和工业固氮的部分K值。
| 反应 |
大气固氮 N2 (g)+O2 (g)  2NO(g) 2NO(g) |
工业固氮 N2 (g)+3H2 (g)  2NH3(g) 2NH3(g) |
|||
| 温度/℃ |
27 |
2000 |
25 |
400 |
450 |
| K |
3.84×10-31 |
0.1 |
5×108 |
0.507 |
0.152 |
①分析数据可知:大气固氮反应属于__________(填“吸热”或“放热”)反应。
②分析数据可知:人类不适合大规模模拟大气固氮的原因__________。
③从平衡视角考虑,工业固氮应该选择常温条件,但实际工业生产却选择500℃左右的高温,解释其原因_______________________。
|
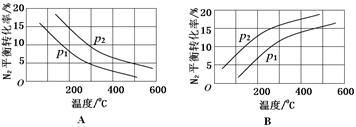
(2)工业固氮反应中,在其他条件相同时,分别测定N2的平衡转化率在不同压强(р1、р2)下随温度变化的曲线,下图所示的图示中,正确的是________(填“A”或“B”);比较р1、р2的大小关系_________。
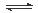 4NH3(g)+3O2(g),则其反应热ΔH=___________________。
4NH3(g)+3O2(g),则其反应热ΔH=___________________。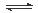 2NH3(g) △H=-92.4kJ·mol-1
2NH3(g) △H=-92.4kJ·mol-1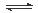 2H2O(l) △H=-571.6kJ·mol-1
2H2O(l) △H=-571.6kJ·mol-12SO2(g)+O2(g) 2SO3(g)反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH1=-99 kJ·mol-1
2SO3(g)反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH1=-99 kJ·mol-1
请回答下列问题:
(1)该反应属于________反应(填“放热”或“吸热”)。
(2)图中C表示。
(3)从化学键的角度分析,F代表什么意义?F;
(4)改变反应条件可改变E值大小,如加入V2O5作催化剂,可使E值减小。E的大小对该反应的反应热有。(无影响、有影响、不确定)
(5)图中ΔH=________kJ·mol-1。
(6)若已知1 mol SO2(g)氧化为1 mol SO3(l)的ΔH2=-Q kJ·mol-1,则ΔH1______ΔH2(填“>”、“<”或“=”)。
(第(1)小题每空1分,其余每空2分,共12分)
A、B、C、D四种短周期元素,原子序数依次增大,A、C同主族,C、D同周期,B原子最外层电子数是最内层电子数的3倍。A、B可形成A2B和A2B2两种液态化合物,B、C也可形成C2B和C2B2两种固态化合物。C+具有与氖原子相同核外电子排布。D原子最外层电子数比B原子最外层电子数多一个电子,根据以上条件,判断:
(1)四种元素分别是(写元素符号) A B C D
(2)用电子式写出A2B化合物的形成过程___; 用电子式写出C2B化合物的形成过程___;
(3)A2B2中加少量MnO2反应的化学方程式________;C2B2与CO2反应的化学方程_____。
有X、Y、Z三种短周期元素,X的气态氢化物化学式为H2X,此氢化物的相对分子质量与X最最高价氧化物的相对分子质量之比为17∶ 40,X原子核内质子数与中子数相等,Y与X可以形成离子化合物Y2X,Y的阳离子电子层结构与Ne相同,Z与X同周期,其气态单质是双原子分子,两原子共用1对电子。试回答:
(1)写出各元素名称:X、Y、Z。
(2)X与Y形成的离子化合物的电子式为 ______ ,Z的单质通入澄清石灰水反应的离子方程式是 _____。
(3)Y单质在空气中燃烧产物与水反应的化学方程式为____________________。
(8分) 已知可充电电池是一种可反复使用的电池。铅蓄电池是生活中常用的可充电电池,其充电过程与放电过程是完全相反的两个过程。其反应总方程式为:
请回答下列问题:放电时,给出电子的一极是(填电极名称),发生反应(填反应类型),其电极反应式为:。该极充电时将发生反应(填反应类型)。
(1)有几种元素的微粒电子层结构如图 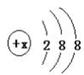 所示,其中:
所示,其中:
①某电中性微粒一般不和其他元素的原子反应,这种微粒符号是________。
②某微粒的盐溶液,加入AgNO3溶液时会出现白色浑浊,这种微粒的电子式是______。
③某微粒氧化性甚弱,但得到电子后还原性强且这种原子最外层有一个电子,这种微粒符号是__。
④某微粒具有还原性,且这种微粒失去2个电子即变为原子,这种微粒的符号是__
(2)11—18号元素中,其单质相互化合能形成种离子化合物,最高价氧化物对应水化物酸性最强的元素是;最高价氧化物对应水化物碱性最强的物质的化学式为;气态氢化物稳定性最强的物质的电子式是________。