I.氟乙烯在耐热性和化学稳定性上都超过了其他塑料,号称“塑料之王”,可用于制造
飞机、导弹的无油轴承,密封填料,人造血管,滑雪板,不粘锅等。其合成路线如下
图所示:

写出下列化学反应方程式。
B→C: ;
C→D: 。
Ⅱ.牛奶放置时间长了会变酸,这是因为牛奶中含有不少乳糖,在微生物的作用下乳糖分
解而变成乳酸,乳酸的结构简式为
(1)乳酸分子中含有________和_________两种官能团(写名称);
(2)已知有机物中若含有相同的官能团,则化学性质相似。完成下列问题:
乳酸与足量金属钠反应的化学方程式为___________________。
仔细体会下列有机合成过程中碳骨架的构建及官能团引入和转化,完成下题:
已知两个醛分子在NaOH溶液作用下可以发生加成反应,生成一种羟基醛: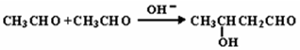
肉桂醛F(分子式为C9H8O)在自然界存在于桂油中,是一种常用的植物调味油,工业上主要是按如下路线合成的: .
.
已知:反应⑤为羟醛缩合反应。请回答:
(1)肉桂醛F的结构简式为:。E中含氧官能团的名称为。
(2)反应①~⑥中符合绿色化学思想的是。
(3)写出下列转化的化学方程式:
②;
⑤。
写出有关反应的类型:③;⑥。
(4)符合下列要求的E物质的同分异构体有种(苯环上有两个取代基,其中有一个甲基在对位,且属于酯类)。
已知:A是石油裂解气的主要产物之一,其产量常用于衡量一个石油化工发展水平的标志。下列是有机物A~G之间的转化关系:
请回答下列问题:
(1)A的官能团的名称是________________;C的结构简式是________________;
(2)E是一种具有香味的液体,由B + D→的反应方程式为:__________,该反应类型是____________;
(3)G是一种高分子化合物,其结构简式是______________;
(4)比赛中,当运动员肌肉挫伤或扭伤时,随队医生即对准受伤部位喷射物质F(沸点12.27OC)进行应急处理。写出由A制F的化学反应方程式:___________________,决定F能用于冷冻麻醉应急处理的性质是___________________。
(18分)有机化合物G是合成维生素类药物的中间体,其结构简式为
G的合成路线如下:
其中A~F分别代表一种有机化合物,合成路线中部分产物及反应条件已略去。
已知:
请回答下列问题:
(1)G的分子式是;G中官能团的名称是。
(2)第①步反应的化学方程式是。
(3)第②~⑥步反应中属于取代反应的有(填步骤编号)。
(4)第④步反应的化学方程式是。
(5)写出同时满足下列条件的E的所有同分异构体的结构简式。
① 只含一种官能团;
②链状结构且无―O―O―;
③核磁共振氢谱只有2种峰。
化合物Ⅰ是制备液晶材料的中间体之一,分子式为:(C11H12O3),其分子中含有醛基和酯基。Ⅰ可以用E和H在一定条件下合成:
已知以下信息:
①A的核磁共振氢谱表明其只有一种化学环境的氢;
②R—CH=CH2 R—CH2CH2OH
R—CH2CH2OH
③化合物F苯环上的一氯代物只有两种;
④通常在同一个碳原子上连有两个羟基不稳定,易脱水形成羰基。
回答下列问题:
(1)A的化学名称为_________________。
(2)D的结构简式为_________________。
(3)E的分子式为___________________。
(4)F生成G的化学方程式为____,该反应类型为___________。
(5)I的结构简式为___________________。
(6)I的同系物J比I相对分子质量小14,J的同分异构体中能同时满足如下条件:
①苯环上只有两个取代基,②既能发生银镜反应,又能和饱和NaHCO3溶液反应放出CO2,共有18种(不考虑立体异构)。J的一个同分异构体发生银镜反应并酸化后核磁共振氢谱为三组峰,且峰面积比为2:2:1,写出J的这种同分异构体的结构简式______________________。
下列A~I九种物质之间的转化关系如图所示,其中部分生成物或反应条件已略去。已知A在常温下为黑色固体单质,常温下C、E、F都是无色气体。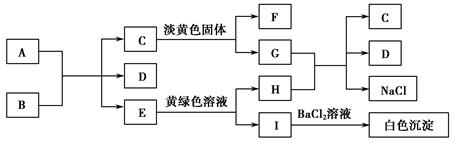
请回答下列问题:
(1)A固体是,B的化学式是。
(2)C与淡黄色固体反应的化学方程式是。
(3)E转变为H和I的离子方程式是;
G与H反应的离子方程式是。