高铁电池是一种可逆电池,该电池能长时间保持稳定的放电电压。高铁电池总反应为3Zn+2K2FeO4+8H20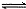 3Zn(OH)2+2Fe(OH)3+4KOH。下列判断不正确的是
3Zn(OH)2+2Fe(OH)3+4KOH。下列判断不正确的是
| A.放电时,负极反应为Zn-2e-+2OH一=Zn(OH)2 |
| B.充电时,阴极pH增大 |
| C.放电时,若有6mol电子转移,则正极有10 mol OH一移向负极 |
| D.充电时,阳极反应为Fe(OH)3+5OH一+3e一=FeO42-+4H2O |
在一条件下,可逆反应2A(g)+B(g)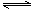 nC(s)+D(g)达平衡。若维持温度不变,增大压强,测得混合气体的平均相对分子质量不变,则下列判断正确的是()
nC(s)+D(g)达平衡。若维持温度不变,增大压强,测得混合气体的平均相对分子质量不变,则下列判断正确的是()
| A.其它条件不变,增大压强,平衡不发生移动 |
| B.其它条件不变,增大压强,混合气体的总质量不变 |
| C.该反应式中n值一定为2 |
D.若原混合气中A与B的物质的量之比为2:1,则 |
下图为可逆反应A(g)+2B(g) nC(g)△H>0生成物C的浓度随压强变化并建立平衡的关系图,则n值与压强p1、p2的关系正确的是( )
nC(g)△H>0生成物C的浓度随压强变化并建立平衡的关系图,则n值与压强p1、p2的关系正确的是( )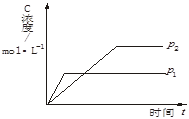
| A.p2>p1,n<3 |
| B.p2>p1,n>3 |
| C.p1>p2,n<3 |
| D.p1>p2,n>3 |
下列说法正确的是()
| A.25℃时NH4Cl溶液的水的离子积常数Kw大于100℃时NaCl溶液的Kw |
B.SO2通入碘水中,反应的离子方程式为SO2+I2+2H2O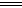 SO32―+2I―+4H+ SO32―+2I―+4H+ |
| C.加入铝粉能产生H2的溶液中,可能存在大量的Na+、Ba2+、AlO2―、NO3- |
| D.100℃时,将pH=2的盐酸与pH=12的NaOH溶液等体积混合,溶液显中性 |
25℃时,向VmL pH=a的盐酸中,滴加pH=b的NaOH溶液10VmL时,溶液中的Cl-和Na+的物质的量相等,则a+b的值是()
| A.13 | B.14 | C.15 | D.不能确定 |
反应A(g)+B(g) C(g) +D(g) 发生过程中的能量变化如图,△H表示反应的焓变。下列说法正确的是()
C(g) +D(g) 发生过程中的能量变化如图,△H表示反应的焓变。下列说法正确的是()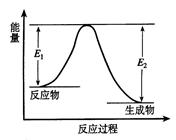
| A.反应体系中加入催化剂,反应速率增大,E1减小,E2增大 |
| B.反应体系中加入催化剂,反应速率增大,△H不变 |
| C.△H < 0,反应达到平衡时,升高温度,A的转化率增大 |
| D.反应达到平衡时,加入A,再次平衡时A的转化率增大 |