已知氧化性:HClO>Cl2>Fe3+>SO42-;常温下,电离常数:K(H2CO3)>K(HClO)>K(HCO3-)>K[Al(OH)3];则下列相关离子方程式正确的是
| A.0.5mol/L的NaHSO3溶液与1.0mol/L的NaClO溶液等体积混合: HSO3-+ClO-=SO42-+Cl-+H+ |
| B.小苏打溶液与偏铝酸钠溶液混合:HCO3-+AlO2-+H2O=Al(OH)3↓+CO32- |
| C.“84”消毒液(主要成分为NaClO)露置在空气中变质: 2ClO-+CO2+H2O=CO32-+2HClO |
| D.在“84”消毒液中滴加FeSO4溶液:2Fe2++ClO-+H2O=2Fe3++Cl-+2OH- |
下列有机物命名正确的是
A. 2-甲基-1-丙醇 2-甲基-1-丙醇 |
B.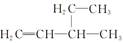 3-乙基-1-丁烯 3-乙基-1-丁烯 |
C.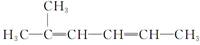 2-甲基-2,4-己二烯 2-甲基-2,4-己二烯 |
D. 3,4, 4-三甲基己烷 3,4, 4-三甲基己烷 |
下列反应无论怎样调整反应物的用量都只能生成一种物质的是
| A.甲烷和氯气混合后光照发生反应 | B.乙烯与氯化氢的加成反应 |
| C.1,3—丁二烯与氢气发生反应 | D.乙炔和氯气的加成反应 |
在有机物分子中,若碳原子连接四个不同的原子或原子团,该碳原子称为手性碳原子,以*C表示。具有手性碳原子的有机物具有光学活性。下列分子中,没有光学活性的是
| A.乳酸:CH3—CH(OH)—COOH |
| B.甘油:CH2(OH)—CH(OH)—CH2(OH) |
| C.脱氧核糖:CH2(OH)—CH(OH)—CH(OH)—CH2—CHO |
| D.核糖:CH2(OH)—CH(OH)—CH(OH)—CH(OH)—CHO |
三联苯 的一氯代物有( )种同分异构体。
的一氯代物有( )种同分异构体。
| A.3 | B.4 | C.2 | D.5 |
酚酞是中学阶段常用的酸碱指示剂,结构简式如图所示:下列关于酚酞的说法错误的是
| A.酚酞与水可以形成氢键 |
| B.酚酞的分子式为C20H14O4 |
| C.酚酞结构中含有羟基(—OH),故酚酞属于醇 |
| D.酚酞在一定条件下能够发生加成反应 |