以煤为主要原料可以制备乙二醇,相关工艺流程下:

(1)写出方法l在催化剂的条件下直接制取乙二醇的化学方程式____________________
(2)合成气在不同催化剂作用下,可以合成不同的物质。下列物质仅用合成气为原料就能得到且原子利用率为100%的是 ____(填字母)。
A.草酸( HOOC-COOH) B.甲醇(CH3OH) C.尿素[CO(NH2)2]
(3)工业上还可以利用天然气(主要成分为CH4。)与C02反应制备合成气。已知:

则CH4与CO2生成合成气的热化学方程式为
(4)方法2:在恒容密闭容器中投入草酸二甲酯和H2发生如下反应:

为提高乙二醇的产量和速率,宜采用的措施是___________(填字母)。
A.升高温度 B.增大压强 C.增大氢气浓度
(5)草酸二甲酯水解生成草酸:

①草酸是二元弱酸,可以制备 (草酸氢钾),
(草酸氢钾), 溶液呈酸性,用化学平衡原理解释: 。
溶液呈酸性,用化学平衡原理解释: 。
②在一定的 溶液中滴加NaOH溶液至中性。下列关系一定不正确的是 (填字母)。
溶液中滴加NaOH溶液至中性。下列关系一定不正确的是 (填字母)。
A.
B.
C.
(6)乙二醇、空气在KOH溶液中构成燃料电池,加入乙二醇的电极为电源的 (填“正”或“负”)级,负极反应式为 。
将20g Ba(OH)2·8H2O晶体与10 g NH4Cl晶体一起放入烧杯中,将烧杯放在滴有3~4滴水的玻璃片上,用玻璃棒迅速搅拌。
(1)实验中玻璃棒的作用是。
(2)写出有关反应的化学方程式。
(3)实验中观察到的现象有、和反应混合物成糊状。
(4)该反应为(填“吸热”或“放热”)反应,这是由于反应物的总能量(填“小于”或“大于”)生成物的总能量。
如图所示,已知A元素最低化合价为-3价,它的最高价氧化物含氧56.36%,原子核内中子数比质子数多1个,试回答:
⑴写出它们的元素符号:
A______B______C______D______E______。
⑵A、B、C、D的气态氢化物稳定性最差的是____________。(用分子式表示)写出B的氢化物的结构式____________。
⑶指出C在元素周期表中的位置____________。
⑷A、B、C三元素最高价氧化物对应水化物的酸性由强到弱的顺序是___________。(用分子式表示)
选择适宜的材料和试剂设计一个原电池,完成下列反应:
Zn + CuSO4 = ZnSO4 + Cu(1)注明电极材料和电解质溶液各是什么?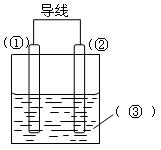
(2)写出电极反应式:
正极:;
负极:。
下列各项决定于原子结构的哪一部分:①质子数,②中子数,③原子的最外层电子数。(以下各项选择序号填空)
⑴元素的种类取决于 ;
⑵原子的质量数主要由 决定;
⑶元素的化学性质主要由 决定。
用电子式表示。
①氧原子___________________②氮气___________________
③氯化镁的形成过程