铁及其化合物与生活密切相关,古代炼丹家以绿矾(FeSO4·7H2O为原料,放在炼丹炉中锻烧可制得绿矾油。绿矾油是一种无色粘稠液体,可用于除掉兵器上的铁锈。右图是2. 78 g绿矾隔绝空气受热分解时,所得固体产物的质量随温度变化的曲线。将加热产生的所有气体通入足量的BaCl2溶液.得自色沉淀1.16g。
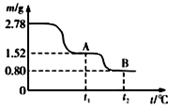

(1)绿矾油主要成份的化学式为 。t1~t2.发生反应的化学方程式为 。
(2)若将28.8 g草酸亚铁(FeC2O4)隔绝空气加热至100℃,得到14.4 g黑色细粉,则可推知该黑色细粉为 。
(3)以下是FeSO4·7H2O的实验室制备流理图
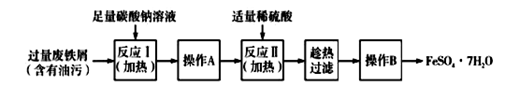
根据题意完成下列填空:
①反应II需要100 mL1. 5 mol·L-1的稀H2SO4溶解洁净的铁屑,用质量分数为98%、密度为1. 84 g·cm -3的浓H2SO4配制。所用的仪器有量筒、烧杯、玻璃捧、胶头滴管及 。
②操作A的名称为 。
③测定FeSO4·7H2O产品中Fe2+含量的常用方法是KMnO4溶液滴定法。已知称取6.0 g FeSO4·7H2O产品,配制成溶液,用硫酸酸化的0.2000 mol·L -1KMnO4溶液滴定,消耗KMnO4溶液的体积为20. 00 mL。发生反应的离子方程式为 ,计算上述样品中FeSO4·7H2O的质量分数为 (保留两位有效数字)。
在300 ℃时,5 L密闭容器中,有分子式为A2和B2的两种气体,生成另外一种气体C,其反应情况如图2-3所示:
图2-3
则该反应的化学方程式为:__________________;用A表示该反应的平均反应速率为_______。
下表数据是在某高温下,金属镁和镍分别在氧气中进行氧化反应时,在金属表面生成氧化薄膜的实验纪录:
| 反应时间t/h |
1 |
4 |
9 |
16 |
25 |
| MgO层厚Y/nm |
0.05a |
0.20a |
0.45a |
0.80a |
1.25a |
| NiO层厚Y′/nm |
B |
2b |
3b |
4b |
5b |
(表中a和b均为与温度有关的数据)
请完成下列问题:
(1)金属高温氧化腐蚀速率可以用金属氧化膜的生长速率来表示,其理由是:__________
_______________________________________________________________________________。
(2)金属氧化膜的膜厚Y跟时间t所呈现的关系类型:MgO氧化膜厚Y与t属___________型,NiO氧化膜Y′与t属______________型(填“直线”“抛物线”“对数”或“双曲线”等类型)。
(3)Mg与Ni比较,哪一种金属具有更良好的耐氧化腐蚀性:________________,其理由是:
_______________________________________________________________________________。
A(g)+3B(g) 2C(g),在10 ℃、50 ℃时均达到平衡,分别测得v(B)="0.3" mol·L-1·s-1,v(A)="25.6" mol·L-1·s-1,则对于此反应而言,温度每升高10 ℃,反应速率增大到原来_________________的倍。
2C(g),在10 ℃、50 ℃时均达到平衡,分别测得v(B)="0.3" mol·L-1·s-1,v(A)="25.6" mol·L-1·s-1,则对于此反应而言,温度每升高10 ℃,反应速率增大到原来_________________的倍。
在容积为2 L的容器中,放入0.4 mol A和0.6 mol B,在一定温度下,压强为p,放入催化剂(催化剂体积忽略不计)发生反应,2A(g)+3B(g) xC(g)+2D(g),在a min后,容器中c(A)="0.1" mol·L-1,此时,若温度与压强均未改变,则v(B)=_______________________,x=______________;若温度不变,压强为
xC(g)+2D(g),在a min后,容器中c(A)="0.1" mol·L-1,此时,若温度与压强均未改变,则v(B)=_______________________,x=______________;若温度不变,压强为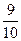 p,则v(C)="____________" mol·L-1·min-1,x=
p,则v(C)="____________" mol·L-1·min-1,x=
_____________________。
经过长期实践,人们总结出反应速率和反应物浓度间的定量关系:在恒温下,对简单反应来说,化学反应速率同反应物浓度方次乘积成正比(反应物浓度的方次,等于反应式中各化学式前的化学计量数)。如:对于反应式mA+Nb====C,v=K[A]m·[B]m(其中K为常数)。
今有一反应aA+bB====C,在25 ℃时,将A、B溶液按不同浓度混合,得下列实验数据:
| A的浓度/mol·L-1 |
B的浓度/mol·L-1 |
反应速率/mol·L-1·s-1 |
| 1.0 |
1.0 |
1.2×10-2 |
| 1.0 |
4.0 |
1.92×10-1 |
| 4.0 |
1.0 |
4.8×10-2 |
分析以上数据,求出a、b的值:a=_________________,b=_________________。