相同温度下,体积均为0.25 L的两个恒容密闭容器中发生可逆反应:N2(g)+3H2(g)  2NH3(g) ΔH=-92.6 kJ·mol-1。实验测得起始、平衡时的有关数据如表所示:
2NH3(g) ΔH=-92.6 kJ·mol-1。实验测得起始、平衡时的有关数据如表所示:
| 容器 编号 |
起始时各物质的物质的量/mol |
达到平衡时体 系能量的变化 |
||
| N2 |
H2 |
NH3 |
||
| ① |
1 |
3 |
0 |
放出能量:23.15 kJ |
| ② |
0.9 |
2.7 |
0.2 |
放出热量:Q |
下列叙述错误的是( )
A.容器①、②中反应的平衡常数相等
B.平衡时,两个容器中NH3的体积分数均为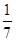
C.容器②中达到平衡时N2的转化率为25%
D.若容器①体积为0.5 L,则平衡时放出的热量<23.15 kJ
11P+ 15CuSO4+ 24H2O = 5Cu3P+ 6H3PO4 + 15H2SO4反应中,被氧化的P原子与被还原的P原子个数比是 ()
| A.6:5 | B.5:6 | C.11:5 | D.11:6 |
在碱性溶液中能大量共存且溶液为无色透明的离子组是()
| A.K+、MnO4-、Na+、Cl- | B.K+、Na+、NO3-、CO32- |
| C.Na+、OH-、NO3-、SO42- | D.Fe3+、Na+、Cl-、S O42- O42- |
能用H++OH-=H2O来表示的化学反应是()
| A.氢氧化镁和稀盐酸反应 | B.Ba(OH)2溶液滴入稀硫酸中 |
| C.澄清石灰水和稀硝酸反应 | D.二氧化碳通入澄清石灰水中 |
下列反应属于氧化还原反应的是()
| A.MnO2+4HCl=MnCl2+Cl2↑+ 2H2O | B.CaO+H2O=Ca(OH)2 |
C.2H2O2 2H2O+O2↑ 2H2O+O2↑ |
D.CaCO3 CaO+CO2↑ CaO+CO2↑ |
将某溶液逐滴加入Fe(OH)3胶体内,开始时产生沉淀,继续滴加时沉淀又溶解,该溶液是()
| A.2 mol·L-1H2SO4溶液 | B.2 mol·L-1NaOH溶液 |
| C.2 mol·L-1MgSO4溶液 | D.硅酸溶胶 |