欲测定含少量氯化钠的小苏打固态样品中NaHCO3的质量分数可采用以下四种方法。
方法一:

方法二:
方法三:
方法四:不使用化学试剂,使用实验室常用仪器
按要求回答下列问题:
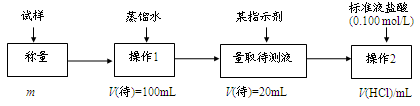
(1)方法一:加入足量的试剂A (填写A的化学式)可将HCO3— 离子转化为沉淀并称重。操作1、2、3、4的名称依次是溶解、 、洗涤和干燥(烘干);
(2)方法二:在操作1中所用到的玻璃仪器中,除了烧杯、玻璃棒、胶头滴管外,还需要的用到的是 ,在操作2中应选择甲基橙指示剂.
(3)在方法二中计算该样品中NaHCO3的质量分数为 [用流程图中的数据m、V(HCl) 填写有关的表达式];
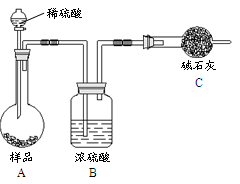
(4)在方法三中:根据所用的实验装置,除了称量试样质量外,还需测定的实验数据是 ;
(5)仔细分析方法三中的实验装置,若由此测得的数据来计算实验结果,则有可能偏高也有可能偏低,偏高的原因可能是 ,偏低的原因可能是 (均文字简述);
(6)方法四的实验原理是: (用化学方程式表示)。
下表是稀硫酸与某金属反应的实验数据:
| 实验序号 |
金属 质量/g |
金属状态 |
c(H2SO4) /mol·L-1 |
V(H2SO4) /mL |
溶液温度/℃ |
金属消失的时间/s |
|
| 反应前 |
反应后 |
||||||
| 1 |
0.10 |
丝 |
0.5 |
50 |
20 |
34 |
500 |
| 2 |
0.10 |
粉末 |
0.5 |
50 |
20 |
35 |
50 |
| 3 |
0.10 |
丝 |
0.7 |
50 |
20 |
36 |
250 |
| 4 |
0.10 |
丝 |
0.8 |
50 |
20 |
35 |
200 |
| 5 |
0.10 |
粉末 |
0.8 |
50 |
20 |
36 |
25 |
| 6 |
0.10 |
丝 |
1.0 |
50 |
20 |
35 |
125 |
| 7 |
0.10 |
丝 |
1.0 |
50 |
35 |
50 |
50 |
| 8 |
0.10 |
丝 |
1.1 |
50 |
20 |
34 |
100 |
分析上述数据,回答下列问题:
(1)实验4和5表明, 对反应速率有影响,能表明同一规律的实验还有 (填实验序号);
(2)本实验中影响反应速率的除了浓度还有 ,仅表明该因素对反应速率产生影响的实验有 (填实验序号)。
(3)实验中的所有反应,反应前后溶液的温度变化值(约15℃)相近,推测其原因 。
如图所示,U型管的左端被水和胶塞封闭有甲烷和氯气(体积比为1:4)的混和气体,假定氯气在水中溶解度可以忽略。将封闭有甲烷和氯气的混和气体的装置放置在有光亮的地方,让混和气体缓慢的反应一段时间。
(1)假设甲烷与氯气反应充分,且只产生一种有机物,请写出化学方程式。
(2)经过几个小时的反应后,U型管右端的玻璃管中水柱变化是。
| A.升高 | B.降低 | C.不变 | D.无法确定 |
(3)甲烷通常用来作燃料,其燃烧反应的化学方程式是。
(4)若用甲烷—氧气构成燃料电池,电解质溶液为KOH溶液,试写出该电池的正极的电极反应式;负极的电极反应式。
某学生用下图所示的装置测定镁的相对原子质量: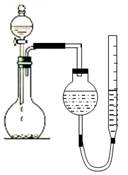
(1)①实验前必须对装置进行气密性检查,具体操作是:;
(2)如果量气管的最大测量体积为50mL(假设条件为标准状况),则取金属镁条(设纯度为100%)的质量不超过g;(精确到0.001)
(3)实验结束,在读取数据前必须:a冷却,使温度恢复到原来状态;b;
(4)该学生实验时称取镁条0.051g(已除去氧化膜),实验结果收集到气体48.00mL(已换算到标准状况,其他实验操作均正确),根据实验测定,镁的相对原子质量为;产生误差的原因可能是(写出一点)。
某无色溶液由Mg2+、Al3+、Cl-、NH4+、SO42-中的若干种离子组成。按以下步骤进行实验:
(1)取原溶液少量于试管中,向试管中不断加入氢氧化钠溶液至过量,有白色沉淀生成而后又完全消失,说明原溶液中一定含有的离子是(填相应离子符号,下同)。
(2)取实验①后的溶液于另一试管中,加热,用湿润的红色石蕊试纸置于试管口,结果试纸变蓝,说明原溶液中一定含有的离子是。
(3)取原溶液加入少量盐酸使溶液酸化,再加入氯化钡溶液,产生白色沉淀,说明原溶液中一定含有的离子是。
(4)取实验③的溶液加入少量,加入硝酸银溶液,产生白色沉淀,能否说明原溶液中一定含有的Cl-离子(是或否)。若要检测Cl-离子是否存在,正确的操作是(若前一格填是,这一格不填)。
某化学小组以苯甲酸( )为原料,制取苯甲酸甲酯。已知有关物质的沸点如下表:
)为原料,制取苯甲酸甲酯。已知有关物质的沸点如下表:
| 物质 |
甲醇 |
苯甲酸 |
苯甲酸甲酯 |
| 沸点/℃ |
64.7 |
249 |
199.6 |
Ⅰ.合成苯甲酸甲酯粗产品
在圆底烧瓶中加入12.2g苯甲酸(M=122g/mol)和20ml甲醇(密度约0.79g·mL-1),再小心加入3mL浓硫酸,混匀后,投入几粒碎瓷片,小心加热使反应完全,得苯甲酸甲酯粗产品。
(1)若反应产物水分子中有同位素18O,写出能表示反应前后18O位置的化学方程式;浓硫酸的作用是:。
(2)甲、乙、丙三位同学分别设计了如下图三套实验室合成苯甲酸甲酯的装置(夹持仪器和加热仪器均已略去)。根据有机物的沸点,最好采用装置(填“甲”或“乙”或“丙”)。
Ⅱ.粗产品的精制
(3)苯甲酸甲酯粗产品中往往含有少量甲醇、硫酸、苯甲酸和水等,现拟用下列流程进行精制,请根据流程图写出操作方法的名称。操作Ⅰ操作Ⅱ。
(4)能否用NaOH溶液代替饱和碳酸钠溶液?(填“能”或“否”),并简述原因。
(5)通过计算,苯甲酸甲酯的产率是。