在密闭容器中,加入3mol A和1mol B,一定条件下发生反应
3A(g)+B(g) 2C(g)+D(g),达平衡时,测得C的浓度为w mol/L,若保持体积和温度不变,重新按下列配比作起始物质,达到平衡时,C的浓度仍然为w mol/L的是( )
2C(g)+D(g),达平衡时,测得C的浓度为w mol/L,若保持体积和温度不变,重新按下列配比作起始物质,达到平衡时,C的浓度仍然为w mol/L的是( )
| A.6mol A+2mol B |
| B.1.5mol A+0.5mol B+1mol C+0.5mol D |
| C.3mol A+1mol B+2mol C+1mol D |
| D.4mol C+1mol D |
下列用品的有效成分及用途对应错误的是()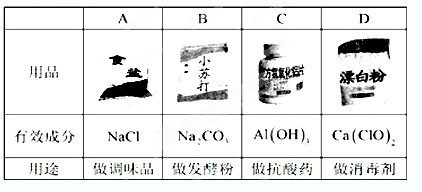
下列事实与氢键有关的是
| A.水加热到很高温度都难以分解 |
| B.水结成冰体积膨胀,密度变小 |
| C.CH4、SiH4、GeH4、SnH4熔点随相对分子质量增大而升高 |
| D.NH3的热稳定性比PH3强 |
某小组为研究电化学原理,设计如下图装置。下列叙述不正确的是()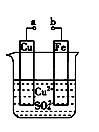
| A.a和b不连接时,铁片上会有金属铜析出 |
| B.a和b用导线连接时,铜片上发生的反应为:Cu2++2e-===Cu |
| C.a和b用导线连接时,电子由铜电极流向铁电极 |
| D.无论a和b是否连接,铁片均会溶解,溶液均从蓝色逐渐变成浅绿色 |
化学与生活密切相关,下列有关说法正确的是()
| A.维生素C具有还原性,能在人体内起抗氧化作用 |
| B.糖类、蛋白质、油脂都属于天然高分子化合物 |
| C.煤经气化、液化和干馏三个物理变化过程,可变为清洁能源 |
| D.糖尿病人应少吃含糖类的食品,可常喝糯米八宝粥 |
下列实验操作或记录正确的是( )
| A.常温常压下测得1molN2的质量为28g |
| B.用量筒测得排水法收集制得的氢气体积为50.28mL |
| C.用两只250mL的容量瓶配制0.1mol/L500mL的NaOH溶液 |
| D.用托盘天平称得2.5g胆矾,受热充分失水后,固体质量减轻1.6g |