X、Y、Z、L、M五种元素的原子序数依次增大。X、Y、Z、L是组成蛋白质的基础元素,M是地壳中含量最高的金属元素。
回答下列问题:
(1)L的元素符号为________ ;M在元素周期表中的位置为________________;五种元素的原子半径从大到小的顺序是____________________(用元素符号表示)。
(2)Z、X两元素按原子数目比l∶3和2∶4构成分子A和B,A的电子式为___,B的结构式为____________。
(3)硒(se)是人体必需的微量元素,与L同一主族,Se原子比L原子多两个电子层,
则Se的原子序数为_______,其最高价氧化物对应的水化物化学式为_______。
该族2~5周期元素单质分别与H2反应生成lmol气态氢化物的反应热如下,表
示生成1mol硒化氢反应热的是__________(填字母代号)。
a.+99.7 mol·L-1 b.+29.7 mol·L-1
c.-20.6 mol·L-1 d.-241.8 kJ·mol-1
奶油中含有一种只含C、H、O的化合物A。A可用做香料,其相对分子质量为88,分子中C、H、O个数比为2∶4∶1。
(1)与A分子式相同的酯有________种。
已知:①ROH+HBr(氢溴酸)  RBr+H2O
RBr+H2O
A中含有碳氧双键,与A相关的反应如下:
(2)E→F的反应类型为__________反应。
(3)A、C的结构简式:A、C。
(4)写出B→D反应的化学方程式:_________________________________。
(5)在空气中长时间搅拌奶油,A可转化为相对分子质量为86的化合物G,G的一氯代物只有一种,写出G的结构简式:__________。
A、B、C、D均为中学所学的常见物质且均含有同一种元素,它们之间的转化关系如下图所示(反应条件及其他物质已经略去): 。
。
(1)若A、D的水溶液均呈酸性,且D为强酸。
①则A、D分别为A:,D:。(填写化学式,下同)
②写出B→C转化的化学方程式:。
③简述检验B物质的方法。
④写出D的浓溶液和Cu在加热条件的化学方程式。
(2)若A的水溶液能使湿润的红色石蕊试纸变蓝,D的稀溶液能使蓝色的湿润石蕊试纸变红。
①则C为
②写出实验室制取A的化学方程式。
③1.92g铜投入一定量D的浓溶液中,铜完全溶解,共收集到672mL气体(标准状况)。将盛有此气体的容器倒扣在水中,通入标准状况下一定体积的O2,恰好使气体完全溶于水中,则通入O2的体积为mL。
(3)在铁和铜的混合物中,加入一定量的稀硝酸,使之充分反应,剩余金属m1g,再向其中加入一定量的稀硫酸,充分振荡后,剩余金属m2 g,则m1与m2关系是(填写字母符号)
A.m1一定大于m2B.m1可能大于m2
C.m1可能等于m2D.m1一定等于m2
已知A、B、C、D、E是化学中常见的物质,常温下,E是一种无色无味的液体,它们之间有如下反应关系。
若A是一种黑色单质,B是一种常见的难挥发性酸,C、D都是气体,则A为:B为:(填化学式)
(2)若A是一种紫红色单质,B是一种常见的挥发性酸,反应时生成的C是无色气体,反应的离子方程式是,B在反应中表现出的性质是、。
(3)若实验室中利用A和B的反应制备气体C,C是一种无色、刺激性气味、密度比空气小的气体,则C为:D为:(填化学式),实验室检验C的常用方法是。
A、B、C、X均为中学化学常见物质,一定条件下有如图所示转化关系(其他产物已略去),下列说法错误的是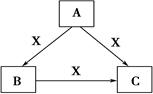
A.若A、B、C均为焰色反应呈黄色的化合物,则X可为CO2
B.若X为KOH溶液,则A可为AlCl3
C.若X为O2,则A可为硫化氢
D.若X为Cl2,则C可为FeCl3
(9分)有机物A为烃的含氧衍生物,其中含C占55.8%,H占7%,其它为氧,且A分子的所有C原子在同一条直线上,D为二溴代烃。有如下转变过程:其中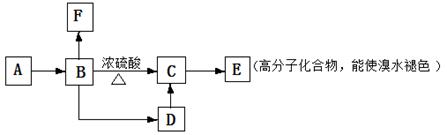
❶B,D分子均达饱和,❷F为五元环状分子,有2种环境不同氢,❸一个碳上不能连两个羟基。请回答:
(1)A,F结构简式分别为_______________________,_______________________,
(2)B→D的反应类型_______________________,
(3)1molB的同分异构体中能与足量的Na反应,产生1mol气体还有_________种(除B外)
(4)写出D→C的化学反应方程式________________________________________,
C→E的化学反应方程式__________________________________________,