Li﹣Al/FeS电池是一种正在开发的电动车用二次电池,该电池反应式为:2Al+6Li++3FeS=2Al3++3Li2S+3Fe.有关该电池的下列说法中,错误的是( )
| A.作为二次电源,该电池在使用的过程中至少存在3种形式的能量转化 |
| B.Li﹣Al在电池中作为负极材料,负极的电极反应式为Li﹣e﹣=Li+ |
| C.该电池替代现在电动车广泛使用的铅蓄电池可以减少重金属的污染 |
| D.充电时,阳极发生的电极反应式为:Li2S+Fe﹣2e﹣=2Li++FeS |
H2SO3、H2CO3分别属于中强酸和弱酸,H2SO3 H+ + HSO3- HSO3-
H+ + HSO3- HSO3- H+ + SO32- H2CO3
H+ + SO32- H2CO3 H+ + HCO3-;HCO3-
H+ + HCO3-;HCO3- H+ + CO32-;已知K1 > K1' ≈ K2 > K2',则溶液中不可以大量共存的离子组合是()
H+ + CO32-;已知K1 > K1' ≈ K2 > K2',则溶液中不可以大量共存的离子组合是()
| A.SO32-、HCO3- | B.HSO3-、CO32- | C. SO32-、CO32- | D.HSO3-、HCO3- |
下列各项中的两个量,其比值一定为2:1的是()
A.在密闭容器中,N2 + 3H2 2NH3达到平衡时的c (NH3)与c (N2) 2NH3达到平衡时的c (NH3)与c (N2) |
| B.0.1 mol / L Na2CO3溶液中的c (Na+)与c (CO32-) |
| C.在反应2 H2S + SO2 → 3 S + 2 H2O中被氧化与被还原的硫原子的质量 |
| D.相同温度下,0.2 mol / L 醋酸溶液与0.1 mol / L 醋酸溶液中的c(H+) |
在一定条件下,固定容积的密闭容器中反应:2NO2(g)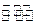 O2(g) + 2NO(g) —Q(Q>0),达到平衡。当改变其中一个条件X,Y随X的变化符合图中曲线的是()
O2(g) + 2NO(g) —Q(Q>0),达到平衡。当改变其中一个条件X,Y随X的变化符合图中曲线的是()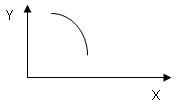
| A.当X表示温度时,Y表示NO2的物质的量 |
| B.当X表示压强时,Y表示NO2的转化率 |
| C.当X表示反应时间时,Y表示混合气体的密度 |
| D.当X表示NO2的物质的量时,Y表示O2的物质的量 |
某K2CO3样品中含有Na2CO3、KNO3和Ba(OH)2三种杂质中的一种或两种。现将13.8克样品加入入足量水,样品全部溶解,再加入过量的CaCl2溶液,得到9克沉淀。对样品所含杂质的正确判断是()
| A.一定含有KNO3 | B.一定含有KNO3,可能含有Na2CO3 |
| C.一定不含Ba(OH)2,可能含有KNO3 | D.一定不含Na2CO3和Ba(OH)2 |
下列溶液中有关判断正确的是()
A.常温下pH = 2的HA溶液与pH = 12的MOH溶液任意比混合:
C (H+) + c (M+) =" c" (OH-) + c (A-)
B.pH相等的CH3COONa、 NaOH和Na2CO3三种溶液:
C (NaOH) < c (CH3COONa) < c (Na2CO3)
C.物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合:
C (CH3COO-) + 2c (OH-) =" 2c" (H+) + c (CH3COOH)
D. 0.1 mol / L的NaHA溶液,其pH = 4:c (HA-) > c (H+) > c (H2A) > c (A2-)