随着能源与环境问题越来越被人们关注,碳一化学(C1化学)成为研究的热点。“碳一化学”即以单质碳及CO、 、
、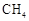 、
、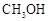 等含一个碳原子的物质为原料合成工业产品的化学与工艺。
等含一个碳原子的物质为原料合成工业产品的化学与工艺。
(1)将 转化成有机物可有效实现碳循环。
转化成有机物可有效实现碳循环。 转化成有机物的例子很多,如:
转化成有机物的例子很多,如:
a.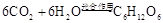
b.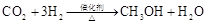
c.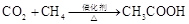
d.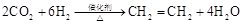
在以上属于人工转化的反应中,原子利用率最高的是 (填序号)。
(2)CO可用于合成甲醇。在压强0.1MPa条件下,在体积为bL的密闭容器中充入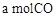 和
和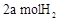 ,在催化剂作用下合成甲醇:
,在催化剂作用下合成甲醇: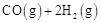

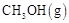 。平衡时CO的转化率与温度、压强的关系如下图。
。平衡时CO的转化率与温度、压强的关系如下图。
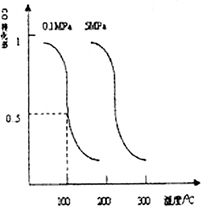
①该反应属于 反应(填“吸热”或“放热”)。若一个可逆反应的平衡常数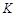 值很大,对此反应的说法正确的是 (填序号)。
值很大,对此反应的说法正确的是 (填序号)。
a.反应使用催化剂意义不大
b.该反应发生将在很短时间内完成
c.该反应达到平衡时至少有一种反应物百分含量很小
d.该反应一定是放热反应
②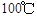 时,该反应的平衡常数
时,该反应的平衡常数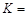 (用
(用 的代数式表示)。
的代数式表示)。
(3)二甲醚(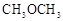 )被称为21世纪的新型燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上可利用煤的气化产物(水煤气)合成二甲醚。
)被称为21世纪的新型燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上可利用煤的气化产物(水煤气)合成二甲醚。
①工业上利用水煤气合成二甲醚的三步反应如下:
a.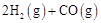

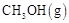
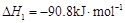
b.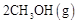

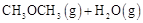
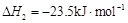
c.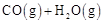

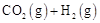
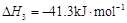
总反应: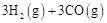

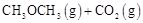 的
的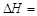 。
。
②对于反应b,在温度和容积不变的条件下,能说明该反应已达到平衡状态的是 (填字母)。
a.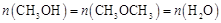
b.容器内压强保持不变
c.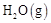 的浓度保持不变
的浓度保持不变
d.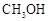 的消耗速率与
的消耗速率与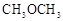 的消耗速率之比为
的消耗速率之比为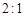
(4)以KOH溶液为电解质,用二甲醚-空气组成燃料,其中负极的电极反应式为 。
(5)C1化合物在治理汽车尾气方面也大有可为,如CO、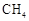 等在一定条件下均可以与氮氧化物生成无污染的物质。写出CO与氮氧化物(NO
等在一定条件下均可以与氮氧化物生成无污染的物质。写出CO与氮氧化物(NO )在有催化剂的条件下反应的化学方程式 。
)在有催化剂的条件下反应的化学方程式 。
在温度为830°K时,下列可逆反应具有某些特殊性质:CO+H2O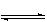 H2+CO2若起始浓度[CO]为2mol/L、[H2O]=
H2+CO2若起始浓度[CO]为2mol/L、[H2O]= 3mol/L,反应达到平衡时,CO的转化率为60%;如果将H2O的起始浓度加大到6mol/L,则CO的转化率为75%。请注意上述有关数据,并总结出规律,完成下列问题:
3mol/L,反应达到平衡时,CO的转化率为60%;如果将H2O的起始浓度加大到6mol/L,则CO的转化率为75%。请注意上述有关数据,并总结出规律,完成下列问题:
设830°K时,起始浓度c(CO)为amol/L、c(H2O)为bmol/L,反应达到平衡时c(H2)为cmol/L。
(1)当b不变时,a减少,重新达到平衡时,CO的转化率,H2O的转化率(填“上升”、“下降”或“不变”)
(2)当a=5,c=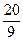 时,b=
时,b=
(3)当a=b时,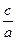 =
=
(4)用以表示a、b、c之间关系的代数式是
(5分) 25℃时,若体积为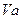 、
、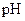 =" a" 的某一元强酸与体积为
=" a" 的某一元强酸与体积为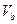 、
、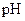 =" b" 的某一元强碱混合,恰好中和,且已知
=" b" 的某一元强碱混合,恰好中和,且已知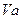 <
<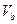 和 a = 0.5b。则:
和 a = 0.5b。则:
(1)a值可否等于3 (填“可”或“否”),其理由是 。
。
(2)a值可否等于5(填“可”或“否”),其理由是。
(3)a 的取值范围__________________________________________________。
从某铝镁合 金片上剪下一小块(质量为1.0g),立即投入到盛有10mL10mol/LNaOH溶液的小烧杯中。
金片上剪下一小块(质量为1.0g),立即投入到盛有10mL10mol/LNaOH溶液的小烧杯中。
(1)自反应开始到反应结束,从小烧杯中可观察到的主要现象。(请依次写出)
(2)开始时产生气泡的速率较慢的原因是。
后来的反应速率相当快的原因是。
(3)写出所形成的原电池的负极材料名称:
电 极反应式:
极反应式:
(4)欲利用该反应来测定合金中铝的含量,还应测定的数据。(请逐一写出)
工业上采用Fe、C为电极电解K2MnO4溶液制KMnO4.
(1)电解时,应以作阴极,电解过程中阴极附近溶液pH将会
(2)阳极反应式为(3)总电解反应式为
如下图所示的装置,C、D、E、F、X、Y都是惰性电极。将电源接通后,向乙中滴入酚酞液,在F极附近显红色。试回答以下问题: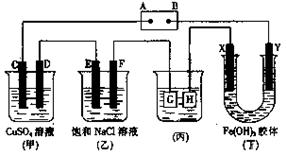
(1)电源A极的名称是。
(2)甲装置中电解反应的总化学方程式是_________________________。
(3)如果收集乙装置中产生的气体,两种气体的体积比是______________。
(4)欲用丙装置给铜镀银,G应该是_______,电镀液的主要成分是_________(填化学式)。