已知:
| 药品名称 |
熔点/℃ |
沸点(℃) |
密度g/cm3 |
溶解性 |
| 正丁醇 |
-89.5 |
117.7 |
0.8098 |
微溶于水、溶于浓硫酸 |
| 1-溴丁烷 |
-112.4 |
101.6 |
1.2760 |
不溶于水和浓硫酸 |
根据题意完成下列填空:
(一)制备1-溴丁烷粗产品在如图装置的圆底烧瓶中依次加入NaBr,10 mL 正丁醇,2粒沸石,分批加入1:1的硫酸溶液,摇匀,加热30 min。

(1).写出制备1-溴丁烷的化学反应方程式:__________________________
(2).反应装置中加入沸石的目的是__________________。配制体积比为1:1的硫酸所用的定量仪器为 (选填编号)。
a.天平 b.量筒 c.容量瓶 d.滴定管
(3).反应装置中,除了产物和水之外,还可能存在 、 等有机副产物。
(4).若用浓硫酸进行实验,有机层中会呈现棕黄色,除去其中杂质的正确方法是
(选填编号)。
a.蒸馏
b.氢氧化钠溶液洗涤
c.用四氯化碳萃取
d.用亚硫酸钠溶液洗涤
(二)制备精品
将得到的粗1-溴丁烷依次用浓硫酸、水、10% 碳酸钠、水洗涤后加入无水氯化钙进行干燥,然后再将1-溴丁烷按图装置蒸馏。

(5).收集产品时,控制的温度应在_________℃左右;区分1-溴丁烷精品和粗品的一种方法是____________________。
(6).实验制得的1-溴丁烷的质量为10.895 g,则正丁醇的转化率为 。(保留3位小数)。
(6分)分离沸点不同但又互溶的液体混合物,常用的方法是;分离不溶性固体和液体混合物的常用的方法是;分离两种溶解度相差很大的溶质的溶液时,常用的方法是。
掌握仪器的名称、组装及使用方法是中学化学实验的基础,下图为两套实验装置。

⑴写出下列仪器的名称:
①;②;④;
⑵仪器①~④中,使用时必须检查是否漏水的有。(填序号)
⑶若利用装置I分离四氯化碳和酒精的混合物,还缺少的仪器有_____________,将仪器补充完整后进行的实验操作的名称为:__________。
(4)现需配制250 ml 0.2 mol/L NaCl溶液,装置II是某同学转移溶液的示意图,图中的错误是_________。
现有含NaCl、Na2SO4和NaNO3的混合物,选择适当的试剂将其转化为相应的沉淀或固体,从而实现Cl-、SO42-、和NO3-的相互分离。相应的实验过程可用下图表示: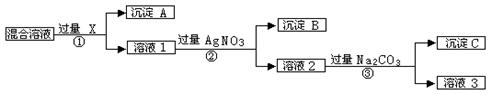
请回答下列问题:
⑴写出实验流程中下列物质的化学式:试剂X _______,沉淀A:_______,沉淀B:__________。
⑵上述实验流程中加入过量的Na2CO3的目的是____________________________
⑶按此实验方案得到的溶液3中肯定含有_____________(填化学式)杂质;为了解决这个问题,可以向溶液3中加入适量的_________,之后若要获得固体NaNO3需进行的实验操作是___________________(填操作名称).
甲、乙两个实验小组分别进行“测定Na2CO3和NaCl混合物中Na2CO3含量”的实验。
(1)甲组:沉淀分析法
把一定量的混合物溶解后加入过量CaCl2,然后将所得沉淀过滤、洗涤、烘干、称量。
确定CaCl2溶液是否过量的方法是____________________________________,
判断沉淀是否洗净的操作是____________________________________________。
(2)乙组:气体分析法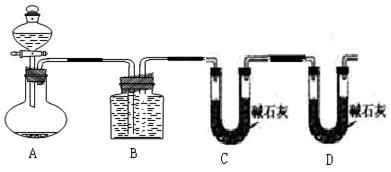
用如图装置进行实验,为了减少误差,分液漏斗中应该用____________溶液,B中应该用_____________________溶液,选用该溶液后实验结果还是不准,请问是_____________,(填“偏高”、“偏低”或“无影响”)原因是______________________________________。
(3)请你设计一个与甲、乙两组操作不同的实验方案,测定混合物中Na2CO3的含量。
方案:__________________________________。
用到的主要试剂:_____________________________________。
用到的玻璃仪器:_____________________________________(至少2件)
用18mol/L的浓硫酸配制100.00mL 1.00mol/L硫酸:
(1)用量筒量取浓硫酸的体积应为mL(保留一位小数),将浓硫酸缓缓倒入盛水的烧杯中后__ __(填“应该”或“不应”)用少量蒸馏水洗涤量筒2~3次并将洗涤溶液也倒入烧杯中。
(2)若实验仪器有:
| A.100mL量筒 | B.托盘天平 | C.玻璃棒 | D.50mL容量瓶 |
E.10mL量筒 F. 胶头滴管 G. 50mL烧杯 H. 100mL容量瓶
实验时应选用的仪器有(填入编号)。
(3)量取浓硫酸时,若俯视液面,则所配稀硫酸溶液浓度________定容时,若俯视液面,则所配溶液浓度 ____(填“偏高”、“偏低”或“无影响”);若不小心加水超过了容量瓶刻度线,应。