用NA表示阿伏加德罗常数,下列说法正确的是( )
| A.2.3 g金属钠与过量的氧气反应,无论加热与否转移电子数均为0.1Na |
| B.1mol Na2CO3晶体中含CO32-离子数小于1NA |
| C.惰性电极电解食盐水,若线路中通过1NA电子电量,则阳极产生气体11.2L |
| D.0.1 mol的CaC2中含阴离子数是0.2 NA |
煤的干馏和石油的分馏两种变化在本质上的差别是
| A.加热的温度不同 | B.得到的产品不同 |
| C.前者要隔绝空气,后者不必 | D.干馏是化学变化,分馏是物理变化 |
某高分子化合物的部分结构如图:关于该物质的下列说法中,正确的是
| A.合成该聚合物的单体是CHC1=CHC1 |
B.聚合物的链节(重复的基本结构单元)为 |
| C.聚合物的分子式为C3H3C13 |
D.该聚合物可表示为 CHC1-CHC1 CHC1-CHC1 ,其中n为定值 ,其中n为定值 |
从石油分馏得到的固体石蜡,用氯气漂白后,燃烧时会产生含氯元素的气体,这是由于石蜡在漂白时与氯气发生过
| A.加成反应 | B.取代反应 | C.聚合反应 | D.催化裂化反应 |
按系统命名法: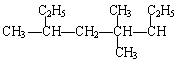 的正确名称是
的正确名称是
| A.1,2,4-三甲基-1,4-二乙基丁烷 | B.3,5,6-三甲基辛烷 |
| C.3-甲基-2,5-二乙基己烷 | D.3,4,6-三甲辛烷 |
下列化学名词正确的是
| A.三溴笨酚 | B.烧碱 | C.乙酸乙脂 | D.石碳酸 |