硫代硫酸钠(Na2S2O3)商品名“海波”,俗名“大苏打”,分析化学上常用于滴定实验。某化学兴趣小组在实验室制备硫代硫酸钠晶体并探究其化学性质。
已知:Na2SO3 + S = Na2S2O3
I.制备Na2S2O3
(1)如图,组装好仪器,检验完气密性(气密性良好),各装置试剂均装入后的下一步操作是______________________________
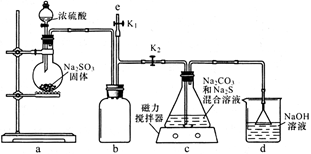
(2)反应开始后,C中发生了多个化学反应。写出其中任意一个非氧化还原反应的方程式___________________________________。
(3)装置c中反应结束后, 先关闭分液漏斗旋塞,在e处连接盛NaOH溶液的注射器,再关闭K2打开K1,其目的是______________________________。待c中溶液冷却后,倒入蒸发皿,通过加热蒸发、冷却结晶和干燥等操作获得Na2S2O3·5H2O晶体。
Ⅱ.探究Na2S2O3的部分化学性质
【提出假设】
假设一:Na2S2O3与Na2SO4结构相似,化学性质也应该相似,因此室温时Na2S2O3 溶液pH=7。
假设二:从S元素的化合价推测Na2S2O3具有较强的还原性。
【验证假设】配制适量Na2S2O3溶液,进行如下实验(请填空)
| |
实验操作 |
实验现象 |
现象解释(用离子方程式表示) |
| 假设一 |
___________________ |
溶液pH=8 |
________________________ |
| 假设二 |
向溴水中滴入适量Na2S2O3溶液 |
溴水褪色 |
___________________________ |
【实验结论】______________________。
Ⅲ:用Na2S2O3的溶液测定溶液中ClO2的物质的量浓度,可进行以下实验:
步骤1:准确量取ClO2溶液10.00 mL,稀释成100 mL试样。
步骤2:量取V1mL试样加入到锥形瓶中,调节试样的pH≤2.0,加入足量的KI晶体,摇匀,在暗处静置30分钟。(已知:ClO2+I-+H+—I2+Cl-+H2O 未配平)
步骤3:以淀粉溶液作指示剂,用c mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2 mL。(已知:I2+2S2O32-=2I-+S4O62-)
根据上述步骤计算出原ClO2溶液的物质的量浓度为 mol·L-1(用含字母的代数式表示)
使用酸碱中和滴定法测定市售白醋的总酸量(g/100mL)。
Ⅰ.实验步骤:
(1)配制100mL待测白醋溶液。量取10.00mL食用白醋,注入烧杯中用水稀释后转移到100mL ___________(填仪器名称)中定容,摇匀即得。
(2)用取待测白醋溶液20.00 mL于锥形瓶中,向其中滴加2滴作指示剂。
3)读取盛装0.1000 mol/L NaOH 溶液的(填仪器名称)的初始读数。如果液面位置如右图所示,则此时的读数为ml。
4)滴定。当时,停止滴定,并记录NaOH溶液的最终读数。再重复滴定3次。
Ⅱ.实验记录
| 滴定次数 实验数据(mL) |
1 |
2 |
3 |
4 |
| V(样品) |
20.00 |
20.00 |
20.00 |
20.00 |
| V(NaOH)(消耗) |
15.95 |
15.00 |
15.05 |
14.95 |
Ⅲ.数据处理与讨论:
(5)甲同学在处理数据时计算得:
平均消耗的NaOH溶液的体积 V =" [(15.95+15.00+15.05+14.95)" /4 ]mL = 15.24mL。
指出他的计算的不合理之处:。
(6)乙同学仔细研究了该品牌白醋的标签,发现其中还含有苯甲酸钠作为食品添加剂,他想用资料法验证醋酸与苯甲酸钠不会发生离子互换反应,需查找在一定温度下的醋酸与苯甲酸的(填写序号)。a.pH b.沸点 c.电离常数 d.溶解度
(7)在本实验的滴定过程中,下列操作会使实验结果偏大的是(填写序号)。
a.未用标准NaOH溶液润洗滴定管
b.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失
c.锥形瓶中加入待测白醋溶液后,再加入少量水
d. 锥形瓶在滴定时剧烈摇动,有少量液体溅出
甲乙两位同学分别用不同的方法配制100mL 3.6mol/L的稀硫酸。
(1)若采用18mol/L的浓硫酸配制溶液,需要用到浓硫酸的体积为。
(2)甲学生:量取浓硫酸,小心地倒入盛有少量水的烧杯中,搅拌均匀,待冷却至室温后转移到100 mL 容量瓶中,用少量的水将烧杯等仪器洗涤2~3次,每次洗涤液也转移到容量瓶中,然后小心地向容量瓶加入水至刻度线定容,塞好瓶塞,反复上下颠倒摇匀。
①将溶液转移到容量瓶中的正确操作是
②洗涤操作中,将洗涤烧杯后的洗液也注入容量瓶,其目的是__。
③定容的正确操作是
④下列操作会使配得的溶液浓度偏小的是()
| A.容量瓶中原有少量蒸馏水 |
| B.溶液从烧杯转移到容量瓶中后没有洗涤烧杯 |
| C.定容时观察液面俯视 |
| D.胶头滴管加水时,有少量水滴到容量瓶外 |
(3)乙学生:用100 mL 量筒量取浓硫酸,并向其中小心地加入少量水,搅拌均匀,待冷却至室温后,再加入水至100 mL 刻度线,再搅拌均匀。
你认为此法是否正确?若不正确,指出其中错误之处
过氧化钠是一种淡黄色固体,它能与二氧化碳反应生成氧气,在潜水艇中用作制氧剂,供人类呼吸之用.它与二氧化碳反应的化学方程式为: 2Na2O2 + 2CO2 ="=" 2Na2CO3 + O2。某学生为了验证这一实验,以足量的大理石、足量的盐酸和1.95g过氧化钠样品为原料,制取O2,设计出如下实验装置:
(1)A中制取CO2 的装置,应从下列图①、②、③中选哪个图: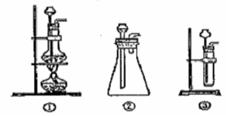
B装置的作用是,C装置内可能出现的现象是。为了检验E中收集到的气体,在取出集气瓶后,
用的木条伸入集气瓶内,木条会出现。
(2)若E中的石灰水出现出现轻微白色浑浊,请说明原因:。
(3)若D中的1.95g过氧化钠样品接近反应完毕时,你预测E装置内有何现象?
(4)你认为上述A-E的实验装置中,E部分是否安全、合理?E是否需要改为下列四项中的哪一项:。(用甲、乙、丙、丁回答)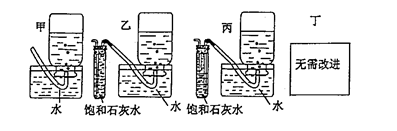
过氧化氢对环境友好,性质多样,有很重要的研究和应用价值。
实验室利用反应2H2O2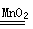 2H2O+O2↑可制备氧气。① 取等物质的量浓度等体积H2O2溶液分别进行下列实验,研究外界条件对该反应速率的影响,实验报告如下表所示。
2H2O+O2↑可制备氧气。① 取等物质的量浓度等体积H2O2溶液分别进行下列实验,研究外界条件对该反应速率的影响,实验报告如下表所示。
| 序号 |
条件 |
现象 |
结论 |
|
| 温度/℃ |
催化剂 |
|||
| 1 |
40 |
FeCl3溶液 |
||
| 2 |
20 |
FeCl3溶液 |
||
| 3 |
20 |
MnO2 |
||
| 4 |
20 |
无 |
实验1、2研究的是对H2O2分解速率的影响。
实验2、3的目的是
实验中可以表明该反应速率差异的现象是
② 实验室用MnO2做该反应的催化剂,使用如右图所示装置的A部分制备O2,避免反应过于剧烈的操作是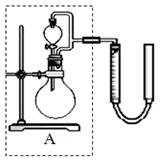
㈠用pH试纸测定溶液pH的正确操作是______________________________________
㈡某校学生用中和滴定法测定某NaOH溶液的物质的量浓度,选甲基橙作指示剂。
⑴盛装0.2000 mol/L盐酸标准液应该用式滴定管。
⑵滴定时,左手控制滴定管,右手摇动锥形瓶,眼睛注视_____________。
⑶ 滴定操作可分解为如下几步:
①检查滴定管是否漏水;
②取一定体积的待测液于锥形瓶中;
③用标准溶液润洗盛标准溶液的滴定管,用待测液润洗盛待测液的滴定管
④装标准溶液和待测液并调整液面(记录初读数)
⑤用蒸馏水洗涤玻璃仪器
⑥滴定操作
正确的操作顺序为:。
⑷有关数据记录如下:则NaOH溶液的物质的量浓度为______________mol/L。
| 实验序号 |
待测液体积(mL) |
所消耗盐酸标准液的体积(mL) |
|
| 滴定前 |
滴定后 |
||
| 1 |
20.00 |
0.50 |
20.55 |
| 2 |
20.00 |
8.00 |
26.00 |
| 3 |
20.00 |
1.40 |
21.35 |
⑸滴定前平视读数,滴定终点时俯视读数,则会使所测碱的浓度值。
(填“无影响”、“偏高”或“偏低”)。