随着各地“限牌”政策的推出,电动汽车成为汽车届的“新宠”。特斯拉全电动汽车使用的是钴酸锂(LiCoO2)电池,其工作原理如下图,A 极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材料,隔膜只允许特定的离子通过,电池反应式LixC6+Li1-xCoO2 C6+LiCoO2。下列说法不正确的是( )
C6+LiCoO2。下列说法不正确的是( )
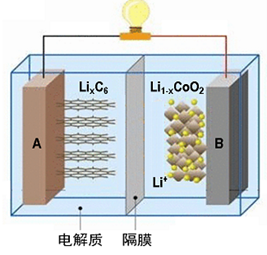
| A.据题意分析可知该隔膜只允许Li+通过,放电时Li+从左边流向右边 |
| B.放电时,正极锂的化合价未发生改变 |
| C.充电时B作阳极,该电极放电时的电极反应式为:Li1-x CoO2+ xLi++ xe-= LiCoO2 |
| D.废旧钴酸锂(LiCoO2)电池进行“放电处理”让Li+进入石墨中而有利于回收 |
化学反应A2 + B2= 2AB的能量变化如图所示,则下列说法正确的是( )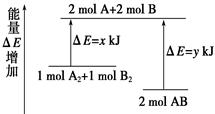
| A.该反应是吸热反应 |
| B.断裂1 mol A—A键和1 mol B—B键能放出x kJ的能量 |
| C.断裂2 mol A—B键需要吸收y kJ的能量 |
| D.2 mol AB的总能量高于1 mol A2和1 mol B2的总能量 |
仿照电极方程式的书写,我们可以把一些氧化还原反应分成“氧化反应”和“还原反应”两个“半反应”,如Fe+2H+=Fe2++H2↑可分成氧化反应:Fe-2e-= Fe2+还原反应:2H++2e-= H2↑则下列正确的是( )
①Fe+2Fe3+=3Fe2+可分成氧化反应:Fe-2e-= Fe2+ 还原反应:2 Fe3+ + 2e-=2 Fe2+
②MnO2+2Cl-+4H+=Mn2++Cl2↑+2H2O可分为
氧化反应:2Cl--2e-=Cl2↑还原反应:MnO2+2e-+4H+=Mn2++2H2O
③Cl2+H2S=S↓+2H++2Cl-氧化反应:H2S- 2e-=S↓+ 2H+还原反应:Cl2+ 2e-=2Cl-
| A.③ | B.②③ | C.①② | D.①②③ |
在一个恒温恒容的密闭容器中发生如下反应,2A(g)+ B(s)  C(g)+3D(g),不能说明该反应达到平衡的是( )
C(g)+3D(g),不能说明该反应达到平衡的是( )
| A.气体总质量不变 | B.混合气体密度不变 |
| C.反应物B的浓度不变 | D.混合气体平均相对分子质量不再改变 |
下列文字表述与反应方程式对应不正确的是( )
| A.氯气和水反应:Cl2+ H2O = 2H+ + Cl-+ ClO- |
| B.用醋酸除去水垢:CaCO3 + 2CH3COOH = Ca2+ +2CH3COO-- + H2O + CO2↑ |
| C.将丙烯通入溴水中:CH3—CH=CH2 +Br2→ CH3CHBrCH2Br |
D.甲烷与氧气反应:CH4+ 2O2 CO2 + 2H2O CO2 + 2H2O |
反应H2(g)+ I2(g) 
 2HI(g)在体积固定的密闭容器中进行,达到平衡状态的标志是( )
2HI(g)在体积固定的密闭容器中进行,达到平衡状态的标志是( )
①单位时间内断裂n mol H-H键的同时形成2n mol H-I键 ②单位时间内生成n molI2的同时生成2n molHI③2v正(H2)=v逆(HI) ④HI分子数不再改变 ⑤混合气体颜色不再改变 ⑥混合气体压强不再改变
| A.②④⑤⑥ | B.②③④⑤ | C.①③④⑤ | D.全部 |