设阿伏加德罗常数为NA,下列叙述正确的是( )
| A.标准状况下,2.24 L 水中所含的电子数为NA |
| B.常温常压下,16 g O3所含的电子数为8NA |
| C.0.1 mol Na2O2晶体中所含的离子数为0.4NA |
| D.1 mol Fe在氧气中充分燃烧失去的电子数为3NA |
某温度下,体积和pH都相同的稀硫酸和硫酸铝溶液加水稀释时的pH变化曲线如图,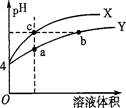
下列有关说法正确的是
| A.加等量的水后硫酸中水电离出的C(H+)与硫酸铝中水电离出的C(H+)的比值比稀释前的比值增大 |
| B.a点溶液中有:c(H+)+c(Al3+)=c(OH-)+c(SO42一) |
| C.体积和pH都相同的稀硫酸和硫酸铝溶液与等浓度的NaOH反应,消耗NaOH的体积相等 |
| D.b、c两溶液水电离出的c(OH-)相等。 |
对下列装置作用的分析或解释正确的是
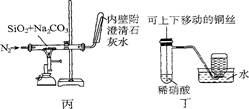
| A.装置甲可除去HCl中的Cl2杂质 |
| B.装置乙可吸收SO2,并防止倒吸 |
| C.装置丙石灰水变浑浊即可证明非金属性:Si>C |
| D.装置丁可制取并收集NO气体 |
有关下列图像的分析错误的是
A.图①可表示对平衡N2+3H2 2NH3加压、同时移除部分NH3时的速率变化。
2NH3加压、同时移除部分NH3时的速率变化。
B.图②中a、b曲线只可表示反应H2(g)十I2(g) 2HI(g)在有催化剂和无催化剂存在下建立平衡的过程。
2HI(g)在有催化剂和无催化剂存在下建立平衡的过程。
C.图③表示室温下将各1 ml pH=2的HA、HB两种酸溶液加水稀释的情况。若2<a<5,则两酸都为弱酸
D.图④中的y可表示将O.1 mol/l稀醋酸加水稀释时溶液导电能力的变化情况
已知下列物质在20℃下的Ksp如下:
| 化学式 |
AgCl |
AgBr |
AgI |
Ag2S |
Ag2CrO4 |
| 颜色 |
白色 |
浅黄色 |
黄色 |
黑色 |
红色 |
| Ksp |
2.0×10-10 |
5.4×10-13 |
8.3×10-17 |
2.0×10-41 |
2.0×10-12 |
下列说法不正确的是
A.20℃时.AgCl饱和溶液和Ag2CrO4饱和溶液中.Ag+物质的量浓度由大到小的顺序是Ag2CrO4>AgCl
B.20℃时,向相同浓度的KCl和KBr混合溶液中逐滴滴加AgNO3溶液.会先生成浅黄色沉淀
C.20℃时,向相同浓度的KCl和KBr混合溶液中逐滴滴加AgNO3溶液,当两种沉淀共存时.c(Br-):C(C1-)=2.7×10-3
D.在100ml AgCl、 AgBr 、AgI饱和的混合溶液中加入足量浓AgNO3溶液,产生沉淀AgI质量最多
分子式为C8H8的某芳香烃,能使酸性高锰酸钾溶液褪色,也能与溴水反应。该芳香烃在一定条件 下与H2完全加成,其生成物的一氯代物的种类有
| A.5种 | B.6种 | C.7种 | D.8种 |