Ⅰ.实验室配制1mol/L Na2CO3溶液250mL。
(1)需要固体Na2CO3 g;
(2)该溶液中的阳离子数目为 个;
(3)需要物质的量浓度为5mol/L 的Na2CO3溶液 mL;
(4)将该溶液与足量稀硫酸反应,产生的气体在标准状况下的体积为 L。
(5)用固体Na2CO3配制该溶液的操作顺序是(用字母表示,不重复使用) 。
| A.称量 | B.洗涤 | C.定容 | D.溶解 E.摇匀 F.转移 |
(6)没有洗涤这步操作,所配制的溶液浓度 (填偏大、偏小或无影响)
Ⅱ.(4分)在25℃、101kPa条件下,将15L O2通往10L CO和H2的混合气中,使其完全燃烧,干燥后,恢复至原来的温度和压强。
(1)若剩余气体的体积是15L,则原CO和H2的混合气体中,V(CO)= L,V(H2)= L。
(2)若剩余气体的体积为a L,则原CO和H2的混合气中,V(CO): V(H2)= 。
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,工业上合成氨反应通常用铁触媒作催化剂,反应方程式为:N2+3H2 2NH3 △H<0。
2NH3 △H<0。
(1)已知N2(g)+3H2(g)  2NH3(g)ΔH=-92kJ·mol-1,拆开1mol H-H键,1molN≡N键分别需要的能量是436kJ、、946kJ,则拆开1molN-H键需要的能量是__________。
2NH3(g)ΔH=-92kJ·mol-1,拆开1mol H-H键,1molN≡N键分别需要的能量是436kJ、、946kJ,则拆开1molN-H键需要的能量是__________。
(2)合成氨反应达到平衡后将容器的容积压缩到原来的1/2,其他条件不变,对平衡体系产生的影响是 (填字母序号)。
| A.c(H2)减小 | B.正反应速率加快,逆反应速率减慢 |
| C.NH3的物质的量增加 | D.平衡常数K增大 |
E.平衡向正方向移动
(3) 如图2所示,在甲、乙两容器中分别充入1molN2和3molH2,使甲、乙两容器初始容积相等。在相同温度下发生反应N2(g)+3H2(g)  2NH3(g) ,并维持反应过程中温度不变。已知甲容器中H2的转化率随时间变化的图像如图3所示,请在图3中画出乙容器中H2的转化率随时间变化的图像。
2NH3(g) ,并维持反应过程中温度不变。已知甲容器中H2的转化率随时间变化的图像如图3所示,请在图3中画出乙容器中H2的转化率随时间变化的图像。

(4)若反应N2(g)+3H2(g)  2NH3(g)在一容积固定不变的容器内进行,并维持反应过程中温度不变。若平衡从正向建立,且起始时N2与H2的物质的量分别为amol、bmol,当a:b=______时,达到平衡后NH3的体积分数最大。
2NH3(g)在一容积固定不变的容器内进行,并维持反应过程中温度不变。若平衡从正向建立,且起始时N2与H2的物质的量分别为amol、bmol,当a:b=______时,达到平衡后NH3的体积分数最大。
高温下CuO(s)+CO(g) Cu(s)+CO2(g)已知该反应在不同温度下的平衡常数如下:1000℃ K=4.0 1150℃ K=3.7 1300℃ K=3.5 ;请回答下列问题:
Cu(s)+CO2(g)已知该反应在不同温度下的平衡常数如下:1000℃ K=4.0 1150℃ K=3.7 1300℃ K=3.5 ;请回答下列问题:
(1)该反应的平衡常数表达式___________.
(2)在一个容积为2L的密闭容器中,1000℃时加入Cu、 CuO、CO、CO2各0.2 mol,反应经过10min后达平衡。求该时间范围内反应的平均反应速率v(CO2)﹦ 。
(3)以下措施中,能使反应(2)中的正反应速率显著加快同时不影响CO的平衡转化率的是 (填字母序号)。
A、增加CO的浓度 B、增加CuO的量 C、移出部分CO2 D、提高反应温度 E、减小容器的容积
(4)1000℃时测得在2L的密闭容器中反应体系中某时刻各物质的物质的量见下表:
| CuO |
CO |
Cu |
CO2 |
| 0.8mol |
0.4mol |
0.6mol |
0.6mol |
此时反应中正、逆反应速率的关系式是 (填代号)。
A.v(正)>v(逆) B.v(正)<v(逆) C.v(正)=v(逆) D.无法判断
由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视。目前工业上有一种方法是用CO2生产燃料甲醇。一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),右图表示该反应进行过程中能量的变化。
CH3OH(g)+H2O(g),右图表示该反应进行过程中能量的变化。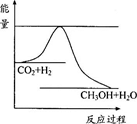
(1)关于该反应的下列说法中,正确的是_______。
| A.△H>0,△S>0; | B.△H>0,△S<0; |
| C.△H<0,△S<0; | D.△H<0,△S>0。 |
(2)该图中能量的最高点和最低点之间的差值代表
(3)以CH4和H2O为原料,通过下列反应来制备甲醇。
①CH4(g)+H2O(g) ="=" CO(g)+3H2(g) △H=+206.0KJ/mol
②CO(g) + 2H2(g) = CH3OH(g) △H=-129.0KJ/mol
CH4(g)和H2O(g)反应生成CH3OH(g)和H2(g)的热化学方程式为 。
合成氨是人类科学技术上的一项重大突破,其反应原理为:
N2(g)+3H2(g) 2NH3(g)∆H= —92.4kJ•mol‾1一种工业合成氨的简易流程图如下:
2NH3(g)∆H= —92.4kJ•mol‾1一种工业合成氨的简易流程图如下:
(1)天然气中的H2S杂质常用氨水吸收,写出氨水的电离方程式 。吸收产物为NH4HS。一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出吸收液再生反应的化学方程式 。
(2)步骤II中制氢气原理如下:
①CH4(g)+H2O(g)  CO(g)+3H2(g) △H=+206.4 kJ·mol-1
CO(g)+3H2(g) △H=+206.4 kJ·mol-1
②CO(g)+ H2O(g)  CO2(g)+H2(g) △H=-41.2 kJ·mol-1
CO2(g)+H2(g) △H=-41.2 kJ·mol-1
则反应CH4(g)+2H2O(g)  CO2(g)+4H2(g) △H= kJ·mol-1。
CO2(g)+4H2(g) △H= kJ·mol-1。
对于反应①,一定可以提高平衡体系中H2百分含量,又能加快反应速率的措施是(填编号) 。
a.升高温度b.增大水蒸气浓度c.加入催化剂d.降低压强
(3)利用反应②,将CO进一步转化,可提高H2产量。若1mol CO和H2的混合气体(CO的体积分数为20%)与H2O蒸气反应,得到1.18mol CO、CO2和H2的混合气体,则CO转化率为 。
(4)下图1表示500℃、60.0MPa条件下,H2和N2为原料气的投料比与平衡时NH3体积分数的关系。根据图中a点数据计算N2的平衡体积分数为 。
(5)依据温度对合成氨反应的影响,在下图2坐标系中,画出一定条件下的密闭容器内,从通入起始原料气开始,随温度不断升高,NH3物质的量变化的曲线示意图。
图1图2
(6)简述本流程中提高合成氨原料总转化率的方法 。
(Ⅰ)浓硝酸与浓盐酸混合过程中会产生少量的黄绿色气体单质X、化合物M和无色液体,化合物M中所有原子均达到8电子的稳定结构。2mol M加热分解生成1mol氧化产物X和2mol无色气体Y,Y遇到空气呈现红棕色。
(1)镁与气体X反应产物的电子式 。
(2)浓硝酸与浓盐酸反应的化学方程式为 。
(3)化合物M水解生成两种酸,为非氧化还原反应,该反应的化学方程式为 。
(Ⅱ)石油铁储罐久置未清洗易引发火灾,经分析研究,事故是由罐体内壁附着的氧化物甲与溶于石油中的气态氢化物乙按1︰3反应生成的物质丙自燃引起的。某研究小组将一定量的丙粉末投入足量的浓盐酸中发生反应,得到4.8g淡黄色固体和气体乙,乙在标准状况下的密度为1.52g·L-1。过滤后向滤液(假设乙全部逸出)中加入足量的NaOH溶液,先出现白色沉淀,最终转变为红褐色沉淀,过滤、洗涤、灼烧后的固体质量为24g。已知气体乙可溶于水。请回答下列问题:
(4)甲的化学式为 。
(5)丙在盐酸中反应的化学方程式为 。
(6)丙与盐酸反应后的滤液暴露在空气中一段时间颜色加深,其原因是(用离子方程式表示) 。
(7)为消除石油铁储罐的火灾隐患,下列措施可行的是(填编号) 。
| A.石油入罐前脱硫 | B.定期用酸清洗罐体 |
| C.罐体内壁涂刷油漆 | D.罐体中充入氮气 |