工业上常用铁质容器盛装冷浓硫酸。为研究铁质材料与热浓硫酸的反应,某学习小组进行了以下探究活动:
(1)将已去除表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移入硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是__________。
(2)另称取铁钉6.0 g放入15.0 mL浓硫酸中,加热,充分应后得到溶液X并收集到气体Y。
①甲同学认为X中除Fe3+外还可能含有Fe2+。若要确认其中的Fe2+,需进行的实验是__________。
②乙同学取336 mL(标准状况)气体Y通入足量溴水中,发生反应:
SO2+Br2+2H2O=2HBr+H2SO4
然后加入足量BaCl2溶液,经适当操作后得干燥固体2.33 g。由此推知气体Y中SO2的体积分数为(简要表述计算过程)__________。
(10分)已知在250C、1.013×105Pa下,1mol氢气完全燃烧生成液态水放出285kJ的热量,请回答下列问题:
(1)若2 mol氢气完全燃烧生成水蒸气,则放出的热量 ___(填“>”、“<”或“=”)570 kJ
(2)现有250C、1.013×105Pa下的H2和CH4的混合气体0.5mol,完全燃烧生成一定质量
的CO2气体和10.8gH2O(l),放出203kJ的热量,则1molCH4完全燃烧生成CO2
气体和H2O(l)的热化学方程式为 ____________________________________ 。
(3)美国阿波罗宇宙飞船上使用了一种新型装置,其构造如图所示:A、B两个电极
均由多孔的碳块组成。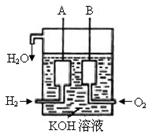
该电池的正极为:__________(填A或B)。若该电池工作时增加了1mol H2O,电
路中转移电子的物质的量为 ____________ 。
(4)如果将上述装置中通往的H2改成CH4气体,也可以组成一个原电池装置,电池的总反应方程式为:CH4+2O2+2KKOH=K2CO3+3H2O,则该电池的负极反应式为:
______________________________________。
物质A、B、C、D、E、F、G、H、I、J、K存在下图转化关系,其中A、H为常见的金属单质,气体D、E为单质,试回答: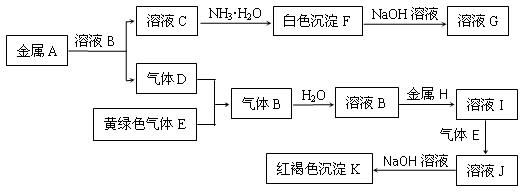
(1)A元素的原子结构示意图为 ________________
(2)写出下列物质的化学式:E是____________ , K是 _________
(3)化合物B属于 ____________化合物(填“离子”或“共价”)
(4)写出反应“F→G”的化学方程式:________________________________________
(5)写出反应“I→J”的离子方程式:_________________________________________
已知周期表中,元素Q、R、W、Y与元素X相邻。Y的最高化合价氧化物的水化物是强酸,Q具有化合价相同且可以相互转变的氧化物,W与Q可以形成一种熔点高、硬度大的高温结构陶瓷材料。回答下列问题:
(1)W的氯化物分子呈正四面体结构,W的氧化物的晶体类型是_________________;
(2)R和Y形成的二元化合物中,R呈现最高化合价的化合物的化学式是 ________;
(3)这5个元素的氢化物分子中,①立体结构类型相同的氢化物的沸点从高到低排列次序是(填化学式)_______________________________,②电子总数相同的氢化物的化学式和立体结构分别是 _________________________________ ;
(4)W和Q所形成的结构陶瓷材料的一种合成方法如下:W的氯化物与Q的氢化物加热反应,生成化合物W(QH2)4和HCl气体;W(QH2)4在高温下分解生成Q的氢化物和该陶瓷材料。上述相关反应的化学方程式(各物质用化学式表示)是__________
________________________________________________________________ 。
一定温度下,在容积为 VL的密闭容器中进行反应:aN(g)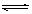 bM(g),M、 N的物质的量随时间的变化曲线如图所示:
bM(g),M、 N的物质的量随时间的变化曲线如图所示: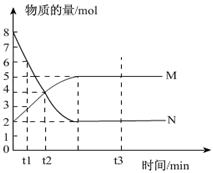
(1)此反应的化学方程式中a/b =" __________"
(2)t1到t2时刻,以M的浓度变化表示的平均反应速率为:______________
(3)下列叙述能说明上述反应达到平衡状态的是
______________(填序号)
| A.反应中M与N的物质的量之比为1︰1 |
| B.混合气体的总质量不随时间的变化而变化 |
| C.混合气体的总物质的量不随时间的变化而变化 |
| D.单位时间内每消耗a mol N,同时生成b mol M |
E.混合气体的压强不随时间的变化而变化
用元素符号(或化学式)回答原子序数从1~18的元素的有关问题
(1)与水反应最剧烈的金属是_____________。
(2)与水反应最剧烈的非金属是_____________
(3)硬度最大的单质是____________。(填名称)
(4)最高正价为+7价的元素是_____________。