Cl2是一种重要的化工原料,下图是一些含氯产品。
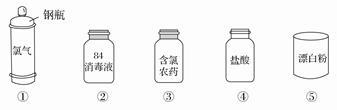
(1)①中钢瓶上应贴的标签为_____________。
A.腐蚀品 B.爆炸品 C.有毒品 D.易燃品
(2)下列有关漂白粉和漂白液的说法正确的是___________。
A.漂白粉是纯净物,漂白液是混合物
B.漂白粉的有效成分是Ca(ClO)2
C.工业上将氯气通入澄清石灰水制取漂白粉
D.漂白液的有效成分是Na2O2
(3)工业上利用Cl2制盐酸,其化学方程式为____________________________。Cl2溶于水可制得氯水,检验一瓶氯水是否已经完全变质,可选用的试剂是_____________。
A.硝酸银溶液 B.酚酞溶液 C.碳酸钠溶液 D.紫色石蕊溶液
(4)将8.7 g MnO2与足量浓盐酸混合加热,反应生成氯气的体积(标准状况)是_________L;被氧化的HCl的质量是_____________g。
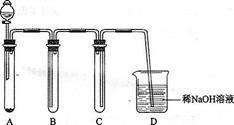
(5)下图是实验室用KMnO4与浓盐酸制取适量氯气的简易装置。

装置B、C、D的作用分别是:
B____________________________;
C____________________________;
D____________________________。
用含有Al2O3及少量Fe2O3和SiO2的铝土矿制备净水剂——液体聚合硫酸铝铁,工艺流程如下(部分操作和条件略):
I.向铝土矿中加入过量H2SO4后,加热、搅拌、过滤。
II.向滤液中加入一定量的FeSO4·7H2O和双氧水。
III.向溶液中加入Ca(OH)2固体,调节溶液的pH约为1,过滤。
IV.加入稳定剂,加热,得到产品。
(1)Fe2O3与H2SO4反应的离子方程式是___________。
(2)步骤I中过滤得到的滤渣成分是________(填化学式)。
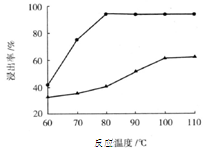
(3)步骤I 中H2SO4的浓度与反应温度会影响铁与铝的浸出率。根据下图分析,步骤I 中H2SO4浓度的适宜范围是__________,反应的适宜温度是_________。
(4)步骤II中增大n(Fe3+)的离子方程式是_________。
(5)步骤III得到碱式硫酸铝铁[AlFe(OH)n(SO4)m]的溶液,则步骤II中应增大n(Fe3+)到
n(Al3+)﹕n(Fe3+)=。
(6)研究表明,液体聚合硫酸铝铁的纯度越高,净水效果越好。已知:
一些物质在20℃时的溶解度
| 物质 |
Ca(OH)2 |
CaSO4 |
Na2SO4 |
| 溶解度/g |
0.153 |
0.258 |
19.5 |
结合表中数据,解释步骤III中使用Ca(OH)2而不用NaOH的原因__________。
(7)铝土矿也可用于冶炼金属Al。以金属Al作阳极,稀硫酸作电解液,通过电解会使金属Al的表面生成致密坚硬的氧化膜,其电极反应式是_________。
氨在国民经济中占有重要地位。
(1)工业合成氨时,合成塔中每产生1 mol NH3,放出46.1 kJ的热量。
① 工业合成氨的热化学方程式是。
② 已知:
N2 (g)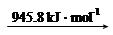 2N (g)
2N (g)
H2 (g)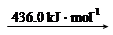 2H (g)
2H (g)
则断开1 mol N-H键所需的能量是_______kJ。
(2)下表是当反应器中按n(N2):n(H2)=1:3投料后,在200℃、400℃、600℃下,反应达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线。
① 曲线a对应的温度是。
② 关于工业合成氨的反应,下列叙述正确的是(填字母)。
A. 及时分离出NH3可以提高H2的平衡转化率
B. 加催化剂能加快反应速率且提高H2的平衡转化率
C. 上图中M、N、Q点平衡常数K的大小关系是K(M)=" K(Q)" >K(N)
③ M点对应的H2转化率是。 (3)氨是一种潜在的清洁能源,可用作碱性燃料电池的燃料。电池的总反应为:
(3)氨是一种潜在的清洁能源,可用作碱性燃料电池的燃料。电池的总反应为:
4NH3(g) + 3O2(g) = 2N2(g) + 6H2O(g)。
则该燃料电池的负极反应式是。
SO2是一种重要的化工原料,也是一种环境污染物。
(1)SO2可用于工业制Br2过程中吸收潮湿空气中的Br2,反应的离子方程式是 。
(2)直接排放含SO2的烟气会形成酸雨,危害环境。用化学方程式表示SO2形成硫酸型酸雨的反应:。
(3)工业上用Na2SO3溶液吸收烟气中的SO2。将烟气通入1.0 mol•L-1的Na2SO3溶液,溶液pH不断减小。当溶液pH约为6时,吸收SO2的能力显著下降,应更换吸收剂。
①此时溶液中c(SO32-)的浓度是0.2 mol•L-1,则溶液中c(HSO3-)是_________mol•L-1,由此说明NaHSO3溶液显性,用化学平衡原理解释:。
②向pH约为6的吸收剂中通入足量的O2,可将其中的NaHSO3转化为两种物质,反应的化学方程式是。
铁元素及其化合物与人类的生产生活息息相关,试回答下列问题:
(1)电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板,该反应的离子方程式为。
(2)已知:Fe(s)+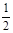 O2(g)
O2(g) FeO(s)△H=-272 kJ·mol-1
FeO(s)△H=-272 kJ·mol-1
C(s)+O2(g) CO2(g)△H=-393.5 kJ·mol-1
CO2(g)△H=-393.5 kJ·mol-1
2C(s)+O2(g) 2CO(g)△H=-221 kJ·mol-1
2CO(g)△H=-221 kJ·mol-1
则高炉炼铁过程中 FeO(s)+CO(g) Fe(s)+CO2(g)△H=。
Fe(s)+CO2(g)△H=。
(3)铁红(Fe2O3)是一种红色颜料。将一定量的铁红溶于160mL 5 mol·L-1盐酸中,再加入足量铁粉,待反应结束共收集到气体2.24L(标准状况),经检测溶液中无Fe3+,则参加反应的铁粉的质量为。
(4)以H2、O2、熔融盐Na2CO3组成燃料电池,采用电解法制备Fe(OH)2,装置如下图所示,其中P端通入CO2。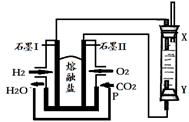
①石墨I电极上的电极反应式为 。
②通电一段时间后,右侧玻璃管中产生大量的白色沉淀,且较长时间不变色。则下列说法中正确的是(填序号)。
| A.X、Y两端都必须用铁作电极 |
| B.可以用NaOH溶液作为电解液 |
| C.阴极发生的反应是:2H2O+ 2e-= H2↑+ 2OH- |
| D.白色沉淀只能在阳极上产生 |
③若将所得Fe(OH)2沉淀暴露在空气中,其颜色变化为 ,该反应的化学方程式为。
水是生命之源,与人类的生活密切相关。在化学实验和科学研究中,水有多种用途。
(1)下列说法中正确的是(填序号)。
| A.每一个水分子内含有两个氢键 |
| B.水分子间存在范德华力,所以水分子稳定 |
| C.分子间形成的氢键使水的熔点和沸点升高 |
| D.冰熔化时水分子内共价键发生断裂 |
(2)科学家将水置于一个足够强的电场中,在20℃时水分子瞬间凝固形成“暖冰”,则“暖冰”中水分子的空间构型为。
(3)水分子在特定条件下易形成水合氢离子(H3O+)。其中含有的化学键为。
(4)如果需要增大水的电离程度,除了升高温度外,还可以采用的方法有(回答一种即可)。若室温时,将某一元酸HA加水配成0.1 mol·L-1的稀溶液,此时HA在水中有0.1%发生电离,则由HA电离出的c(H+)约为水电离出的c(H+)的倍。
(5)将一定量的Na2SO3固体溶于水,所得溶液中的电荷守恒关系式为。
(6)研究人员最近发现了一种“水”电池,这种电池能利用淡水与海水之间含盐量差异进行发电。已知该电池用金属银做负极,正极反应为5MnO2 +2Na++2e-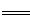 Na2Mn5O10,请写出电池总反应式。
Na2Mn5O10,请写出电池总反应式。