下列框图中的物质均为中学化学中常见物质,其中甲、乙为单质,其余均为化合物,B为常见液态化合物,A为淡黄色固体,F、G所含元素相同且均为氯化物,G遇KSCN溶液显红色。
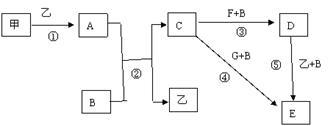
请问答下列问题:
(1)A是____________,G是______________。(填化学式)
(2)反应①-⑤中,属于氧化还原反应的是________________(填序号)。
(3)反应⑤的化学方程式为_______________________,
甲与B反应的离子方程式 _________________________。
在实验室将C溶液滴入F溶液中,观察到的现象是____________________________。
在F溶液中加入等物质的量的A,发生反应的总的离子方程式为:_______________。
已知:酚酞在c(OH-) 为1.0×10-4mol/L~2.5mol/L时呈红色,且半分钟内不褪色。向3.9g A和100g B混合后的溶液中滴入2滴酚酞试液,溶液变红色,片刻红色褪去。(假设过程中液体体积不变)
①甲同学认为“红色迅速褪去”是由于溶液中c(OH-)过大造成的。
上述观点是否正确 ,请通过计算对比数据加以说明____________________________。
②乙同学认为“红色迅速褪去”是由于A + B = 碱 + H2O2 ,H2O2具有氧化性和漂白性导致的。试设计简单实验证明烧瓶内溶液中含H2O2,简述实验原理 。
X是一种可用作果实催熟剂的气体。现有如下的反应关系: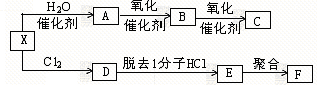
已知F是合成高分子化合物,用于制备塑料和合成纤维。
(1)用结构简式表示:A、C、F;
(2) A→B的化学方程式为,反应类型为。
为提纯下列物质(括号内为少量杂质),填写除杂质试剂及方法:
| 不纯物 |
除杂试剂 |
分离方法 |
| 苯(苯酚) |
||
| 乙醇(水) |
写出下列化学方程式,并注明反应类型
(2)溴乙烷与氢氧化钠的醇溶液在加热条件下反应,反应类型:。
(3)苯酚与溴水的反应,反应类型:。
4分)写出以下键线式所表示的有机物的结构简式: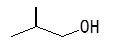
,属于该类有机物的同分异构体还有种。
用质量分数为37.5%的浓盐酸(密度为1.16 g / cm3)配制成1 mol / L的稀盐酸。现实验室仅需要这种盐酸220 mL。试回答下列问题:
(1)配制稀盐酸时,应选用容量为mL的容量瓶;
(2) 经计算需要mL浓盐酸,在量取时宜选用下列量筒中的。
| A.5 mL | B.10 mL | C.25 mL | D.50 mL |
(3) 在量取浓盐酸后,进行了下列操作:
①等稀释的盐酸其温度与室温一致后,沿玻璃棒注入250 mL容量瓶中。
② 往容量瓶中小心加蒸馏水至液面接近环形标线2~3 cm处,改用胶头滴管加蒸馏水,使溶液的凹面底部与瓶颈的环形标线相切。
③ 在盛盐酸的烧杯中注入蒸馏水几十毫升,并用玻璃棒搅动,使其混合均匀。
④ 用蒸馏水洗涤烧杯和玻璃棒2至3次,并将洗涤液全部注入容量瓶。
上述操作中,正确的顺序是(填序号)。
(4) 在上述配制过程中,用刚刚洗涤洁净的量筒来量取浓盐酸,其配制的稀盐酸浓度是
(填“偏高”、“偏低”、“无影响”)。若未用蒸馏水洗涤烧杯内壁或未将洗涤液注入容量瓶,则配制的稀盐酸浓度是(填“偏高”、“偏低”、“无影响”)。