都能用下图所示装置进行喷泉实验的一组气体是( )
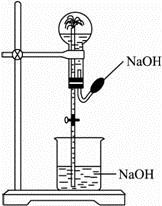
| A.HCl和CO2 | B.NH3和CH4 | C.SO2和CO | D.NO2和NO |
25℃时,下列溶液中微粒存在情况合理的是
| A.Fe2+、Mg2+、ClO-、Cl-能大量共存 |
| B.含Br-、K+、Na+、HSO3-的溶液,通入SO2后这些离子仍能大量共存 |
C.含K+、Na+、NO3-、CH3COO-的溶液中c(H+) |
| D.硝酸钠和碘化钡混合溶液中,溶质离子浓度为c (Ba2+)=0.2mol/L,c(Na+)=0.2mol/L,c(NO3-)=0.3mol/L,c(I-)=0.1mol/L |
某恒温密闭容器中,可逆反应A(s)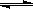 B + C(g) -Q,达到平衡。缩小容器体积,重新达到平衡时,C(g)的浓度与缩小体积前的平衡浓度相等。以下分析正确的是
B + C(g) -Q,达到平衡。缩小容器体积,重新达到平衡时,C(g)的浓度与缩小体积前的平衡浓度相等。以下分析正确的是
A.产物B的状态只能为固态或液态
B.平衡时,单位时间内n(A)消耗﹕n(C)生成=1﹕1
C.保持体积不变,向平衡体系中加入B,平衡可能向逆反应方向移动
D.若开始时向容器中加入1molB和1molC,达到平衡时放出热量Q
下列对化学平衡移动的分析中,不正确的是
①已达平衡的反应C(s)+H2O(g) CO(g)+H2(g),当增加反应物物质的量时,平衡一定向正反应方向移动
CO(g)+H2(g),当增加反应物物质的量时,平衡一定向正反应方向移动
②已达平衡的反应N2(g)+3H2(g) 2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率一定升高
2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率一定升高
③2.0molPCl3和1.0molCl2充入恒容的密闭容器中,发生反应:PCl3(g)+ Cl2(g) PCl5(g)达平衡时,PCl5为0.4mol,如果此时移走1.0 molPCl3 和0.50 molCl2,在相同温度下再达平衡时PCl5的物质的量应大于0.20mol而小于0.40mol
PCl5(g)达平衡时,PCl5为0.4mol,如果此时移走1.0 molPCl3 和0.50 molCl2,在相同温度下再达平衡时PCl5的物质的量应大于0.20mol而小于0.40mol
④有气体参加的反应达平衡时,在恒压反应器中充入稀有气体,平衡不会发生移动
| A.①④ | B.①②③ | C.②③④ | D.①②③④ |
25 ℃、101 kPa下:①2Na(s)+O2(g)=Na2O(s); ΔH1=-414 kJ/mol
②2Na(s)+O2(g)=Na2O2(s); ΔH2=-511 kJ/mol
下列说法正确的是
| A.①和②产物的阴阳离子个数比不相等 |
| B.①和②生成等物质的量的产物,转移电子数不同 |
| C.常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快 |
| D.25 ℃、101 kPa下,Na2O2(s)+2Na(s)=2Na2O(s) ; ΔH=-317 kJ/mol |
化学在人类生活中扮演着重要角色,以下应用正确的是
| A.用浸泡过高锰酸钾溶液的硅土吸收水果释放的乙烯,可达到水果保鲜的目的 |
| B.为改善食物的色、香、味并防止变质,可在其中加入大量食品添加剂 |
| C.使用无磷洗衣粉,可彻底解决水体富营养化问题 |
| D.天然药物无任何毒副作用,可长期服用 |