刻制印刷电路时要用FeCl3溶液作为“腐蚀液”生成CuCl2和FeCl2,其反应的化学方程式:Cu + 2FeCl3 ═ CuCl2 + 2FeCl2
(1)请在上式中标出电子转移的方向和数目
(2)该反应的氧化剂是
(3)使用过的腐蚀液会失效,但还可以回收利用,其中有一步需要将Fe2+转化为Fe3+,下列试剂能实现上述变化的是 (填序号)
| A.氯气 | B.铁 | C.铜 | D.稀硫酸 |
(12分)三氟化氮是一种无色、无味、无毒且不可燃的气体,在半导体加工、太阳能电池制造和液晶显示器制造中得到广泛应用。NF3是一种三角锥型分子,键角102°,沸点-129 ℃,可在铜的催化作用下由F2和过量NH3反应得到。
(1)写出制备 NF3的化学反应方程式:。
(2)NF3的沸点比NH3的沸点(-33 ℃)低得多的主要原因是。
(3)理论上HF、NaAlO2和NaCl按6∶1∶2的物质的量之比恰好反应生成HCl、H2O和一种微溶于水的重要原料,该物质含有三种元素,则该物质的化学式为。
(4)根据下列五种元素的第一至第四电离能数据(单位:kJ·mol-1 ),回答下面各题:
| 元素代号 |
I1 |
I2 |
I3 |
I4 |
| Q |
2080 |
4000 |
6100 |
9400 |
| R |
500 |
4600 |
6900 |
9500 |
| S |
740 |
1500 |
7700 |
10500 |
| T |
580 |
1800 |
2700 |
11600 |
| U |
420 |
3100 |
4400 |
5900 |
①若以上五种元素为前四周期元素,则R为_____________。(填元素符号)
②若五种元素为主族元素,则T为__________区元素。
③若T为第二周期元素,E是第三周期元素中原子半径最小的元素,则T、E形成化合物的空间构型为。
化合物A和浓硫酸共热只生成烃B,红外光谱图显示D中有两个相同的官能团。有关物质之间的转化关系如下: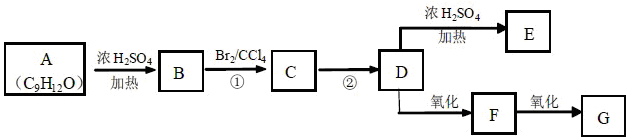
(1)核磁共振氢谱显示A 的侧链中有两种类型的氢原子,A 的含氧官能团的名称是,G的结构简式是;
(2)①的反应类型是,②的反应试剂和条件是;
(3)写出D的结构简式;
(4)A1是与A含有相同官能团的同分异构体,同条件下也只得到B,写出A1生成B的化学方程式。
(10分)按要求回答下列问题:
(1)某元素原子的价电子为3d14s2, 元素符号为_____________,最高正化合价为________。
(2)原子序数为26的元素的原子中有_________个能级,________个未成对电子。
(3)请写出有2个能层且p轨道中只有一对成对电子的基态原子的外围电子排布图________。
(4)请写出次外层电子数是最外层电子数的1/4的元素的基态原子的电子排布式___________。
(5)1~36号元素原子核外电子排布中未成对电子数最多的元素原子的价电子构型为________。
已知元素A的最高正价与最低负价的代数和为零。取5.6g元素A的单质与足量的烧碱溶液完全反应后,生成A的最高价化合物的同时收集到标况下氢气8.96L。元素A的原子核中质子数与中子数相等。
(1)试确定元素A在元素周期表中的位置
(2)写出两种与A的气态氢化物分子具有相同电子数的双原子分子的化学式、。
有A、B、C、D、E、F六种主族元素,已知:
(a) A原子有四个电子层,其K、L层电子数分别与N、M层电子数相等
(b) B、C原子核外电子层比A原子少一层,B的最高正价和负价的代数和等于零.C的气态氢化物化学式是H2C.
(c) D、E的阴离子都带一个单位的负电荷,D的阴离子电子层结构与氩原子相同.E元素没有对应的含氧酸.
(d)F与A属同一周期且是上述六种元素中原子半径最大元素。
则(1)它们的元素名称为:
A:_______ B:________ C:_______ D:_________ E:________F:____
(2)试比较A、C、D、F四种元素的离子半径的大小(用离子符号表示)
(3)B、C、D元素的气态氢化物的稳定性有强到弱的顺序为