已知:A、C、J为日常生活中常见的金属单质,其中A、C均呈银白色,J呈紫红色。A是地壳中含量最高的金属元素,B是一种红棕色金属氧化物。它们之间的转化关系如下图。反应②在工业上可用于制作印刷电路板。请回答下列问题:

(1)写出C和I的化学式: , ;
(2)写出反应①的化学方程式: ,写出反应②的离子方程式: ;
(3)写出反应①在工业上的一种用途 。
实验室欲配制100mL 1.4mol/L的NaOH溶液,试回答:
(1)用不到的仪器是:
A烧杯 B500mL容量瓶 C天平 D胶头滴管 E玻璃棒 F100mL容量瓶
(2)配制时应称取NaOH g
(3)实验开始时,需检查容量瓶
(4)下列操作的顺序中还缺少一步操作是什么
计算冷却称量洗涤定容溶解摇匀
(5)若用1.4 mol/L的NaOH溶液润洗容量瓶,实验结果将 。溶解后立刻转移到容量瓶,结果将____________,如果容量瓶洗净后有水结果将_________。
2molSO3和3molSO2其分子数之比为_________;相同状况下(均为气体)体积之比为___________;氧原子数之比为______________。0.2 mol Al2(SO4)3中含有Al3+___________ mol、SO42-__________ mol.
写出下列盐类水解的离子方程式,并指出其溶液的酸碱性。
(1)硫酸铝溶液: (显 性)。
(2)硝酸铵溶液: (显_ 性)。
(3)次氯酸钠溶液: (显_ 性)。
(4)碳酸氢钠溶液: (显_ 性)。
某同学做如下实验,以检验反应中的能量变化。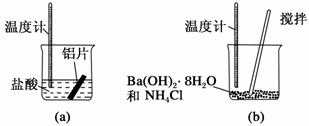
(1)实验中发现反应后(a)中温度升高,由此可以判断(a)中反应是__________热反应;(b)中温度降低,由此可以判断(b)中反应是__________热反应。
(2)根据能量守恒定律,(b)中反应物的总能量应该__________其生成物的总能量。
已知Zn和Fe2O3在高温下发生反应:3Zn + Fe2O3 =" 2Fe" + 3ZnO,其中Zn是____________剂,被_______________,发生__________反应。氧化产物是_______还原产物是 ________。