Ⅰ.实验室制得气体中常含有杂质,影响其性质检验。下图A为除杂装置,B为性质检验装置,完成下列表格:
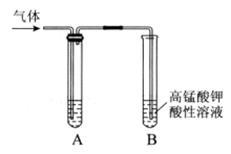
| 序号 |
气体 |
反应原理 |
A中试剂 |
| ① |
乙烯 |
溴乙烷和NaOH的醇溶液加热 |
|
| ② |
乙烯 |
无水乙醇在浓硫酸的作用下加热至170℃反应的化学方程式是。 |
NaOH溶液 |
| ③ |
乙炔 |
电石与饱和食盐水反应 |
|
Ⅱ.为探究乙酸乙酯的水解情况,某同学取大小相同的3支试管,分别加入以下溶液,充分振荡,放在同一水浴加热相同时间,观察到如下现象。
| 试管编号 |
① |
② |
③ |
| 实验操作 |
 |
 |
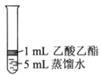 |
| 实验现象 |
酯层变薄 |
酯层消失 |
酯层基本不变 |
(1)试管①中反应的化学方程式是________________;
(2)对比试管①和试管③的实验现象,稀H2SO4的作用是________________;
(3)试用化学平衡移动原理解释试管②中酯层消失的原因。
(9分)现有反应:mA(g)+nB(g) pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
(1)该反应的逆反应为_________热反应,且m+n_________p(填“>”“=”“<”)。
(2)减压时,A的质量分数_________。(填“增大”“减小”或“不变”,下同)
(3)若加入B(体积不变),则A的转化率_________,B的转化率_________。
(4)若升高温度,则平衡时B、C的浓度之比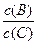 将_________。
将_________。
(5)若加入催化剂,平衡时气体混合物的总物质的量_________。
(6)若B是有色物质,A、C均无色,则加入C(体积不变)时混合物颜色_______;而维持容器内压强不变,充入氖气时,混合物颜色_______(填“变深”“变浅”或“不变”)。
1-1 2011年是国际化学年,是居里夫人获得诺贝尔化学奖100周年。居里夫人发现的两种化学元素的元素符号和中文名称分别是和。
1-2 向TiOSO4水溶液中加入锌粒,反应后溶液变为紫色。在清夜中滴加适量的CuCl2水溶液,产生白色沉淀。生成白色沉淀的离子方程式是;继续滴加CuCl2水溶液,白色沉淀消失,其离子方程式是。
1-3 20世纪60年代维也纳大学V.Gutmann研究小组报道,三原子分子A可由SF4和NH3反应合成;A被AgF2氧化得到沸点为为27℃的三元化合物B。A和B分子中的中心原子与同种端位原子的核间距几乎相等;B分子有一根三种轴和3个镜面。画出A和B的结构式(明确示出单键和重键,不在纸面上的键用楔形键表示,非键合电子不必标出)。
1-4 画出Al2(n-C4H9)4H2和Mg[Al(CH3)4]2的结构简式。
1-5 已知EӨ(FeO42—/Fe3+) =" 2.20" V,EӨ(FeO42—/Fe(OH)3) =" 0.72" V。
①写出氯气和三氯化铁反应形成高铁酸根的离子方程式。。
②写出高铁酸钾在酸性水溶液中分解的离子方程式。。
③用高铁酸钾与镁等组成碱性电池,写出该电池的电极反应。
氧气、干冰、熟石灰和纯碱四种物质分别与下列图中的人类活动有关,请将它们的化学式填在图下相应的括号内。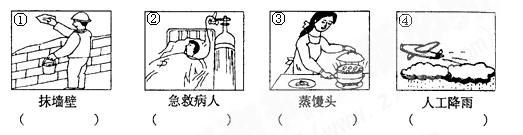
(1)新华网成都8月27日电(记者党文伯)记者27日从四川省达州市宣汉县了解到,26日23时20分,宣汉县上峡乡柳 茂村一非法煤井发生瓦斯事故,目前已致2死、3伤、2人被困。瓦斯的主要成分是甲烷,其化学式为。事故处理专家在处理瓦斯爆炸现场时,提出采用注水或注液氮的灭火方案。你觉得注入液氮可以灭火的原因是:。
茂村一非法煤井发生瓦斯事故,目前已致2死、3伤、2人被困。瓦斯的主要成分是甲烷,其化学式为。事故处理专家在处理瓦斯爆炸现场时,提出采用注水或注液氮的灭火方案。你觉得注入液氮可以灭火的原因是:。
(2)2008北京奥运会火炬设计具有浓烈的中国特色,设计灵感来自中国传统的纸卷轴,用源于汉代的漆红色绘制出祥云图案,高雅华丽、内涵厚重。火炬长72厘米,重985克,燃料为丙烷(C3H8),燃烧的火焰颜色为亮黄色,在强光和日光情况下均可识别和拍摄,燃烧的产物为二氧化碳和水蒸气。火炬外形制作材料为可回收的铝合金环保材料,火炬的下半部喷涂高触感橡胶皮革漆,手感舒适不易滑落,这是首次创造性的在奥运火炬上使用这一材料。
根据以上材料回答下列问题:
①在该火炬材料中,属于金属材料的是。
②请写出丙烷在空气中燃烧的化学方程式;
③用丙烷作奥运会火炬燃料的优点是(写一条)。
用数字和化学符号填空:
⑴氯原子;⑵2个钠离子;⑶3 个二氧化碳分子 ;⑷-2价的硫元素;⑸保持水的化学性质的最小粒子。
;⑷-2价的硫元素;⑸保持水的化学性质的最小粒子。