常温下,将一元酸HA(甲、乙、丙、丁代表不同浓度的一元酸)和NaOH溶液等体积混合,两种溶液的物质的量浓度和混合溶液的pH如下表所示:
| 实验编号 |
HA的物质的量浓度/mol·L-1 |
NaOH物质的量浓度/mol·L-1 |
混合后溶液的pH |
| 甲 |
0.1 |
0.1 |
pH=a |
| 乙 |
0.12 |
0.1 |
pH=7 |
| 丙 |
0.2 |
0.1 |
pH>7 |
| 丁 |
0.1 |
0.1 |
pH=10 |
(1)从甲组情况分析,如何判断HA是强酸还是弱酸?_______________。
(2)乙组混合溶液中离子的浓度c(A-)和c(Na+)的大小关系是________。
A.前者大 B.后者大
C.二者相等 D.无法判断
(3)从丙组实验结果分析,该混合溶液中离子浓度大小顺序为________。
(4)分析丁组实验数据,写出该混合溶液中下列算式的精确结果(列式):
c(Na+)-c(A-)=________mol·L-1。
(16分)能源危机是当前全球问题,开源节流是应对能源危机的重要举措。
⑴下列做法有助于能源“开源节流”的是▲(填字母)。
a.大力发展农村沼气,将废弃的秸秆转化为清洁高效的能源
b.大力开采煤、石油和天然气以满足人们日益增长的能源需求
c.开发太阳能、水能、风能、地热等新能源、减少使用煤、石油等化石燃料
d.减少资源消耗,增加资源的重复使用、资源的循环再生
(2)金刚石和石墨均为碳的同素异形体,它们燃烧氧气不足时生成一氧化碳,充分燃烧生成二氧化碳,反应中放出的热量如右图所示。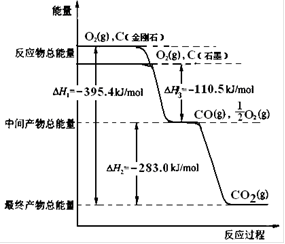
(a)在通常状况下,金刚石和石墨中____▲___(填“金刚石”或“石墨”)更稳定,石墨的燃烧热为____▲___ kJ·mol-1。
(b)12 g石墨在一定量空气中燃烧,生成气体36g,该过程放出的热量 ▲kJ。
(3)已知:N2(g)+O2(g)=2NO(g);ΔH=+180.0 kJ·mol-1。
综合上述有关信息,请写出CO除NO的热化学方程式▲ 。
美国斯坦福大学研究人员最近发明一种“水”电池,这种电池能利用淡水与海水之间含盐量的差别进行发电。
(4)研究表明,电池的正极用二氧化锰纳米棒为材料可提高发电效率,这是利用纳米材料具有
▲ 特性,能与钠离子充分接触。
(5)海水中的“水”电池总反应可表示为:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl,该电池负极反应式为▲;当生成1 mol Na2Mn5O10转移▲ mol电子。
溴被称为“海洋元素”。已知Br2的沸点为59℃,微溶于水,有毒性和强腐蚀性。实验室模拟从海水中提取溴的主要步骤为:
步骤1:将海水蒸发浓缩除去粗盐;
步骤2:将除去粗盐后的母液酸化后,通入适量的氯气,使Br-转化为Br2;
步骤3:向步骤2所得的水溶液中通入热空气或水蒸气,将溴单质吹入盛有二氧化硫水溶液的容器中;
步骤4:再向该容器中通入适量的氯气,使Br-转化为Br2;
步骤5:用四氯化碳萃取溴单质,经分液、蒸馏得粗溴。
(1)步骤3中的反应的离子方程式▲。
(2)步骤2中已经制得了溴,还要进行步骤3和步骤4的原因是▲。
(3)步骤5中萃取和分液所需要的主要玻璃仪器为▲。 (4)用如上图所示的实验装置可精制粗溴。
(4)用如上图所示的实验装置可精制粗溴。

 ①反应过程中需要对A容器加热,加热的方法是▲。
①反应过程中需要对A容器加热,加热的方法是▲。
图中冷却水应从B的▲口进入(填“a”或“b”)。
②C中加冰的目的是▲。
A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出)
(1) 若A为短周期金属单质,D为短周期非金属单质,且所含元素的原子序数A是D的2倍,所含元素的原子最外层电子数D是A的2倍,F的浓溶液与A、D反应都有红棕色气体生成,则A的原子结构示意图为,
反应④的化学方程式为:。
(2) 若A为常见的金属单质,D、F是气态单质,反应①在水溶液中进行,则反应②(在水溶液中进行)的离子方程式是,
在常温下,1g D与F反应生成B时放出92.3kJ热量,写出该反应的热化学方程式。
(3) 若A、D、F都是短周期非金属元素单质,且A、D所含元素同主族,A、F所含元素同周期,则反应①的化学方程式为,分子E的结构式为。
以黄铜矿(主要成份为CuFeS2,含少量杂质SiO2等)为原料,进行生物炼铜,同时得到副产品绿矾(FeSO4·7H2O)。其主要流程如下:

② 部分阳离子以氢氧化物形式开始沉淀和完全沉淀时溶液的pH如下表
| 沉淀物 |
Cu(OH)2 |
Fe(OH)3 |
Fe(OH)2 |
| 开始沉淀pH |
4.7 |
2.7 |
7.6 |
| 完全沉淀pH |
6.7 |
3.7 |
9.6 |
(1)试剂a是,试剂b是(填化学式)。
(2)操作X流程依次为蒸发浓缩、、过滤、洗涤干燥。
(3)反应Ⅱ中加CuO调pH为3.7的目的是;
(4)反应Ⅴ的离子方程式为。
(5)反应①中,每生成1mol Fe2(SO4)3,转移电子的物质的量为mol;
(6)过滤操作中,要用到的玻璃仪器有、和漏斗。
阅读下表中的相关信息。除N外,其余都是主族元素。
| 元素代号 |
相关信息 |
| T |
T的单质能与冷水剧烈反应,所得强碱性溶液中含有两种电子数相同的阴、阳离子 |
| X |
X的原子2p轨道未成对电子数和成对电子数相等 |
| Y |
在第三周期元素中,Y的简单离子半径最小 |
| Z |
T、X、Z组成的36电子的化合物A是家用消毒剂的主要成分 |
| M |
M的氧化物是制造光导纤维的重要原料 |
| N |
位于第四周期,是人类最早使用的金属之一,单质呈红色 |
请按要求回答:
(1)元素T与X按原子个数比1∶1形成的化合物中所含的化学键类型有
,元素M与X形成的化合物B属于晶体(填写晶体类型)。
(2)写出N基态原子电子排布式:。
(3)元素T、Y、Z对应的单质的熔点高低顺序:>>(填化学式)。
(4)元素X、Y形成的简单离子半径大小: >(填相应的离子)。
(5)向Y与Z形成的化合物的水溶液中,加入过量T的最高价氧化物对应水化物的溶液,写出该反应的离子方程式:。
(6) 一定条件下,X、Y两种单质以及有孔惰性电极在化合物TZ的水溶液中可形成原电池,为新型海水航标灯提供能源,该电池正极电极反应是:。