常温下,用0.100 0 mol·L-1 NaOH溶液滴定20.00 mL 0.100 0 mol·L-1 CH3COOH溶液所得滴定曲线如下图。下列说法正确的是( )
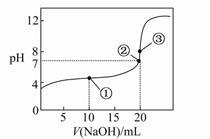
| A.点①所示溶液中:c(CH3COO-)+c(OH-)=c(CH3COOH)+c(H+) |
| B.点②所示溶液中:c(Na+)=c(CH3COOH)+c(CH3COO-) |
| C.点③所示溶液中:c(Na+)>c(OH-)>c(CH3COO-)>c(H+) |
| D.滴定过程中可能出现:c(CH3COOH)>c(CH3COO-)>c(H+)>c(Na+)>c(OH-) |
下列措施或事实不能用勒夏特列原理解释的是:()
| A.新制的氯水在光照下颜色变浅 |
| B.合成NH3反应,为提高NH3的产率,理论上应采取相对较低温度的措施 |
| C.向稀盐酸中加入少量蒸馏水,盐酸中氢离子浓度降低 |
| D.实验室中常用排饱和食盐水的方式收集氯气 |
如图所示,是在其他条件一定时,反应2A+B 2C△H<0,A的最大转化率与温度关系曲线,下列叙述正确的是:()
2C△H<0,A的最大转化率与温度关系曲线,下列叙述正确的是:()
| A.X或Y两点相应,V(正)>V(逆) |
| B.Z、N两点表示未达平衡状态,且都是V(正)>V(逆) |
| C.W点表示非平衡状态,V(正)>V(逆) |
| D.相应反应速率大小的点:W > Y > N |
下列说法错误的是:( )
| A.升高温度可使吸热反应的反应速率增大,使放热反应的反应速率减小 |
| B.决定化学反应速率的主要因素是参加反应的物质的性质 |
| C.对于有气体参加的反应,增大体系的压强,反应速度不一定加快 |
| D.催化剂能降低反应的活化能来提高化学反应速率 |
反应X(g)+3Y(g) 2Z(g) ΔH<0 在不同温度、不同压强(P1>P2)下,达到平衡时,混合气体中Z的体积分数φ(Z)随温度变化的曲线为( )
2Z(g) ΔH<0 在不同温度、不同压强(P1>P2)下,达到平衡时,混合气体中Z的体积分数φ(Z)随温度变化的曲线为( )
A B C D
下列说法中不正确的是()
| A.由Al、Cu、稀H2SO4组成原电池,其负极反应式为: Al-3e-=Al3+ |
| B.由Mg、Al、NaOH溶液组成原电池,其负极反应式为:Al-3e-+4OH-=AlO2-+2H2O |
| C.由Fe、Cu、FeCl3溶液组成原电池,其负极反应式为:Cu-2e-=Cu2+ |
| D.由Al、Cu、浓硝酸组成原电池,其负极反应式为: Cu-2e-=Cu2+ |