在T ℃条件下,向1 L固定体积的密闭容器M中加入2 mol X和1 mol Y,发生如下反应:2X(g)+Y(g) aZ(g)+W(g) ΔH=- Q kJ·mol-1(Q>0)。当反应达到平衡后,反应放出的热量为Q1 kJ,物质X的转化率为α;若平衡后再升高温度,混合气体的平均相对分子质量减小,则:
aZ(g)+W(g) ΔH=- Q kJ·mol-1(Q>0)。当反应达到平衡后,反应放出的热量为Q1 kJ,物质X的转化率为α;若平衡后再升高温度,混合气体的平均相对分子质量减小,则:
(1)化学计量数a的值为____________。
(2)写出该反应的平衡常数表达式K=____________(a必须用具体的值表示)。
(3)下列说法中能说明该反应达到化学平衡状态的是______________________。
A. 容器内压强一定
B. 容器内气体的密度一定
C. 容器内Z分子数一定
D. 容器内气体的质量一定
(4)X的转化率α=________,Y的平衡浓度为__________mol·L-1(均用含Q、Q1的代数式表示);
(5)维持温度不变,若起始时向容器中加入的物质的量如下列各项,则反应达到平衡后放出的热量仍为Q1 kJ的是_________(稀有气体不参与反应)。
A. 2 mol X,1 mol Y,1 mol Ar
B. a mol Z,1 mol W
C. 1 mol X,0.5 mol Y,0.5 mol Z,0.5 mol W
D. 2 mol X,1 mol Y,1 mol Z
在反应2KMnO4+16HCl==2KCl+2MnCl2+5Cl2+8H2O中:
氧化剂是氧化产物是氧化产物与还原产物的物质的量之比为
被氧化与未被氧化的HCl的质量之比为,若有73克HCl被氧化,电子转移的总数为,标准状况下生成Cl2的体积为L.用单线桥标出电子转移的方向和数目
(共12分)下图中A、B、C、D、E、F、G均为有机化合物。
根据上图回答问题:
⑴ D的化学名称是_____________。
⑵ 反应③的化学方程式是________________________________________________。
(有机物须用结构简式表示)
⑶ B的分子式是_____________。A的结构简式是_________________________。反应①的反应类型是___________。
⑷ 符合下列3个条件的B的同分异构体的数目有______个。
i)含有邻二取代苯环结构、ii)与B有相同官能团、iii)不与FeCl3溶液发生显色反应。
写出其中任意一个同分异构体的结构简式___________________________。
⑸ G是重要的工业原料,用化学方程式表示G的一种重要的工业用途______________。
下面列出了几组物质,请将物质的合适组号填写在空格上。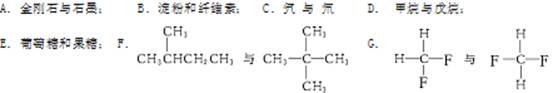
(1)同位素;(2)同素异形体;
(3)同系物;(4)同分异构体;
(5)同一物质。
如下图所示,A为一种常见的单质,B、C、D、E是含有A元素的常见化合物。它们的焰色反应均为黄色。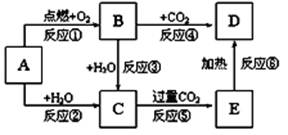
请填写下列空白:
(1)写出反应②的实验现象。
(2)以上反应中属于氧化还原反应的有。(填写编号)
(3) 反应②的化学方程式;
反应⑥的化学方程式。
向D中滴入HCl的化学方程式。
现有常见金属单质A、B 和气体甲、乙、丙及物质C、D,它们之间存在如下转化关系(图中有些反应的产物和反应的条件没有全部标出)。回答下列问题: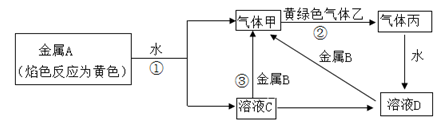
①写出金属B和气体甲的化学式:B,甲;
②黄绿色气体乙可以制漂白液和漂白粉,写出制漂白液的离子方程式
;漂白液的有效成分是。