医用氯化钙可用于生产补钙、抗过敏和消炎等药物。以工业碳酸钙(含有少量Na+、Al3+、Fe3+等杂质)生产医用二水合氯化钙(CaCl2·2H2O的质量分数为97.0%~103.0%)的主要流程如下:
(1)除杂操作是加入氢氧化钙,调节溶液的pH为8.0~8.5,以除去溶液中的少量Al3+、Fe3+。检验Fe(OH)3是否沉淀完全的试验操作是_________________。
(2)酸化操作是加入盐酸,调节溶液的pH约为4.0,其目的有:①将溶液中的少量Ca(OH)2转化为CaCl2;②防止Ca2+在蒸发时水解;③________________________。
(3)测定样品中Cl-含量的方法是:A. 称取0.750 0 g样品,溶解,在250 mL容量瓶中定容;B. 量取25.00 mL待测溶液于锥形瓶中;C. 用0.050 00 mol· L-1 AgNO3
溶液滴定至终点,消耗AgNO3溶液体积的平均值为20.39 mL。
①上述测定过程中需要溶液润洗的仪器有_______________________________。
②计算上述样品中CaCl2·2H2O的质量分数为________________。
③若用上述办法测定的样品中CaCl2·2H2O的质量分数偏高(测定过程中产生的误差可忽略),其可能原因是___________________;____________________。
(6分)在火箭推进器中装有还原剂肼(N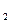 H
H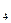 )和强氧化剂H
)和强氧化剂H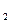 O
O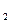 ,当它们混合时,即产生大量的氮气和水蒸气,并放出大量的热。已知0.4 mol 液态肼和足量液态H
,当它们混合时,即产生大量的氮气和水蒸气,并放出大量的热。已知0.4 mol 液态肼和足量液态H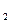 O
O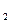 反应生成氮气和水蒸气时放出256.64 kJ的热量。
反应生成氮气和水蒸气时放出256.64 kJ的热量。
(1)写出液态肼和液态H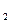 O
O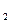 反应的热化学方程式。
反应的热化学方程式。
(2)已知H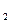 O(l)="===" H
O(l)="===" H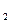 O(g);△H=+44kJ/mol,则16 g液态肼与足量液态H
O(g);△H=+44kJ/mol,则16 g液态肼与足量液态H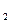 O
O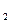 反应生成氮气和液态水时,放出的热量是_____________________。
反应生成氮气和液态水时,放出的热量是_____________________。
(3)上述反应应用于火箭推进器,除释放出大量热量和快速产生大量气体外,还有一个很突出的优点是_______________________________________________________________。
已知一定温度和压强下,在容积为VL的密闭容器中充入1mol A和1mol B,保持恒温恒压下反应:A(g) + B(g)  C(g)△H<0。达到平衡时,C的体积分数为40%。试回答有关问题:
C(g)△H<0。达到平衡时,C的体积分数为40%。试回答有关问题:
(1)升温时,C的反应速率___________(填“加快”、“减慢”或“不变”)。
(2)若平衡时,保持容器容积不变,使容器内压强增大,则平衡___________。
| A.一定向正反应方向移动 | B.一定向逆反应方向移动 |
| C.一定不移动 | D.不一定移动 |
(3)若使温度、压强在上述条件下恒定不变,在密闭容器中充入2mol A和2 mol B,则反应达 到平衡时,C的体积分数为_____________,容器的容积为_____________。
到平衡时,C的体积分数为_____________,容器的容积为_____________。
(8分)(1)对于下列反应:2SO2(g) + O2(g) 2SO3(g) , 如果2min内SO2的浓度由6 mol/L下降为2 mol/L,用O2浓度变化来表示的反应速率为 __________________。
2SO3(g) , 如果2min内SO2的浓度由6 mol/L下降为2 mol/L,用O2浓度变化来表示的反应速率为 __________________。
(2)下图表示在密闭容器中反应:2SO2+O2 2SO3 △H<0达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a~b过程中改变的条件可能是___________________; 请将增大压
2SO3 △H<0达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a~b过程中改变的条件可能是___________________; 请将增大压 强时的反应速率变化情况画在c~d处:
强时的反应速率变化情况画在c~d处:
(3)以上反应达平衡后,若此时只将容器的体积扩大为原来的2倍,达新平衡时,容器内混合气体的平均相对分子质量比原平衡时___________(填“增大”、“减小”或“相等”)。
在一定体积的密闭容器中,进行如下化学反应:
CO2(g)+H2(g) CO(g)+H2O(g),
CO(g)+H2O(g),
其化学平衡常数K和温度t的关系如下表:
| t℃ |
700 |
800 |
830 |
1000 |
1200 |
| K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=。
(2)该反应为反应(选填吸热、放热)。
(3)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为 ℃。
恒温、恒压下,在一个可变容积的容器中发生反应:A(g)+B(g) C(g)
C(g)
(1)若开始时放入1molA和1molB ,达到平衡后,生成a mol C,这时A的物质的量为_________mol。
,达到平衡后,生成a mol C,这时A的物质的量为_________mol。
(2)若开始时放入x mol A,2mol B和1mol C,到达平衡后,A和C的物质的量分别是y mol和3a mol ,则x=_________________mol,y=_________________mol。