为探究NaHCO3、Na2CO3和盐酸(以下盐酸浓度均为1 mol·L-1)反应过程中的热效应,实验测得如下数据:
| 序号 |
35 mL试剂 |
固体 |
混合前 温度/℃ |
混合后 温度/℃ |
| ① |
水 |
2.5 g NaHCO3 |
20.0 |
18.5 |
| ② |
水 |
3.2 g Na2CO3 |
20.0 |
24.3 |
| ③ |
盐酸 |
2.5 g NaHCO3 |
20.0 |
16.2 |
| ④ |
盐酸 |
3.2 g Na2CO3 |
20.0 |
25.1 |
由此得出的结论正确的是( )
A.Na2CO3溶液与盐酸的反应是吸热反应
B.NaHCO3溶液与盐酸的反应是放热反应
C.20.0℃时,含3.2g Na2CO3的饱和溶液和35mL盐酸混合后的温度将低于25.1℃
D.20.0℃时,含2.5g NaHCO3的饱和溶液和35mL盐酸混合后的温度将低于16.2℃
大气中CO2含量的增多除了导致地球表面温度升高外,还会影响海洋生态环境。某研究小组在实验室测得不同温度下(T1,T2)海水中CO32-浓度与模拟空气中CO2浓度的关系曲线。下列说法不正确的是( )
| A.T1>T2 |
| B.海水温度一定时,大气中CO2浓度增加,海水中溶解的CO2随之增大,导致CO32-浓度降低 |
| C.当大气中CO2浓度确定时,海水温度越高,CO32-浓度越低 |
| D.大气中CO2含量增加时,海水中的珊瑚礁将逐渐溶解 |
体积为1L,物质的量浓度均为0.1mol/L的CuSO4和NaCl混合溶液中,用石墨电极进行电解。电解过程中,溶液pH随时间t变化的曲线如图。则下列说法正确的是()
| A.AB段pH增大是因为电解NaCl溶液生成NaOH的缘故 |
| B.BC段在阳极共析出3.2g 铜 |
| C.整个过程中阳极先产生Cl2,后产生O2 |
| D.至C点阴极上共逸出气体1.68L(折算成标准状况) |
不溶于水的氧化亚铜可溶于含硫酸铁的硫酸溶液中,这时生成的硫酸亚铁可用酸性高锰酸钾溶液滴定,从而测定氧化亚铜的量:Cu2O+Fe2(SO4)3+H2SO4——FeSO4+CuSO4+H2O FeSO4+KMnO4+H2SO4——Fe2(SO4)3+MnSO4+K2SO4+H2O由上述反应知;0.1mol/L的KMnO4溶液1mL相当于氧化亚铜的量是( )
| A.360mg | B.3.6g | C.0.36g | D.2.5×10-4mol |
已知电极上每通过96 500 C的电量就会有1 mol电子发生转移。精确测量金属离子在惰性电极上以镀层形式沉积的金属质量,可以确定电解过程中通过电解池的电量。实际测量中,常用银电量计,如图所示。下列说法不正确的是( )
| A.电量计中的银棒应与电源的正极相连,铂坩埚上发生的电极反应是:Ag++e-=Ag |
| B.称量电解前后铂坩埚的质量变化,得金属银的沉积量为108.0mg,则电解过程中通过电解池的电量为96.5C |
| C.实验中,为了避免银溶解过程中可能产生的金属颗粒掉进铂坩埚而导致测量误差,常在银电极附近增加一个收集网袋。若没有收集网袋,测量结果会偏高。 |
| D.若要测定电解饱和食盐水时通过的电量,可将该银电量计中的银棒与待测电解池的阳极相连,铂坩埚与电源的负极相连。 |
化学方程式可简明地体现元素及其化合物的性质。已知氧化还原反应:
2FeCl3 + 2HI = 2FeCl2 + I2 + 2HCl; 2Co(OH)3 + 6HCl = 2CoCl2 + Cl2↑ + 6H2O
2Fe(OH)2 + I2 + 2KOH= 2Fe(OH)3 + 2KI; 3I2 + 6KOH=" 5KI" + KIO3 + 3H2O
复分解反应:2HSCN + K2CO3 =" 2KSCN" + CO2 ↑ + H2O; KCN + CO2 + H2O =" HCN" + KHCO3
热分解反应:4NaClO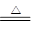 3NaCl + NaClO4;NaClO4
3NaCl + NaClO4;NaClO4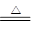 NaCl + 2O2↑
NaCl + 2O2↑
下列说法不正确是( )
| A.氧化性(酸性溶液):FeCl3 > Co(OH)3> I2 |
| B.还原性(碱性溶液):Fe(OH)2 > I2 > KIO3 |
| C.热稳定性:NaCl > NaClO4 > NaClO |
| D.酸性(水溶液):HSCN > H2CO3 > HCN |