某小组同学设想用如图装置电解硫酸钾溶液来制取氧气、氢气、硫酸和氢氧化钾。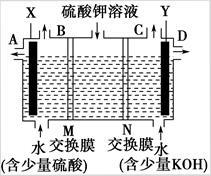
(1)X极与电源的_________(填“正”或“负”)极相连,氢气从____(选填“A”、“B”、“C”或“D”)口导出。
(2)离子交换膜只允许一类离子通过,则M为________(填“阴离子”或“阳离子”,下同)交换膜,N为________交换膜。
(3)若将制得的氢气、氧气和氢氧化钾溶液组合为氢氧燃料电池(石墨为电极),则电池负极的电极反应式为____________________。
(4)若在标准状况下,制得11.2 L氢气,则生成硫酸的质量是________,转移的电子数为________。
研究证明,CO2可作为合成低碳烯烃的原料加以利用,目前利用CO2合成乙烯相关的热化学方程式如下:
反应开始时在0.lMPa下,以n(H2):n(CO2)=3:1的投料比充入体积固定的密闭容器中,发生反应Ⅳ,不同温度下平衡时的四种气态物质的物质的量百分数如图1所示:
请回答下列问题:
(1)△H4=kJ·mol-1。
(2)可以判断该反应已经达到平衡的是 。
A.v(CO2)="2" v (C2H4)
B.混合气体的密度不再改变
C.混合气体的压强不再改变
D.平衡常数K不再改变
E.C2H4的体积分数不变
(3)曲线a表示的物质为 (写化学式),判断依据是 。
(4)为提高CO2的平衡转化率,可以采取的措施是。
A.降低温度
B.分离出H2O
C.增加原催化剂的表面积
D.增大压强
E.投料比改为n(H2):n(CO2)=2:1
(5)在图2中,画出393K时体系中C2H4的积分数随反应时间(从常温进料开始计时)的变化趋势曲线,并标明平衡时C2H4的体积分数数值。
工业上用N2和H2合成NH3 “N2(g) + 3H2(g) 2NH3(g)∆H<0”,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产。请回答下列问题:
2NH3(g)∆H<0”,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产。请回答下列问题:
(1)已知:N2(g) + O2(g) =2NO(g)∆H1=" +a" kJ·mol-1
N2(g) + 3H2(g) 2NH3(g)∆H2=-b kJ·mol-1
2NH3(g)∆H2=-b kJ·mol-1
2H2(g) + O2(g) =2H2O(g)∆H3=-c kJ·mol-1
若有34 g 氨气经催化氧化完全生成一氧化氮气体和水蒸气所放出的热量为。
(2)合成NH3达到平衡后,某时刻改变下列条件,在达到新平衡的过程中正反应速率始终增大。
| A.升温 | B.加压 | C.增大c(N2) | D.降低c(NH3) |
(3)某科研小组研究:在其他条件不变的情况下,改变起始物氢气的物质的量对合成NH3反应的影响。实验结果如图所示:(图中T表示温度,n表示起始时H2物质的量)
①图像中T2和T1的关系是:T2 T1(填“>”、“<”、“=”或“无法确定”)。
②比较在a、b、c三点所处的平衡状态中,反应物N2 的转化率最大的是(填字母)。
③若容器容积为1L,b点对应的n=0.15mol,测得平衡时H2的转化率为60%,则平衡时N2的物质的量浓度
为mol·L-1。
(4)一定温度下,将2molN2和4mol H2置于1L的恒容密闭容器中反应,测得不同条件、不同时间段内合成NH3反应中N2的转化率,得到数据如下表:
上表中a、b、80%三者的大小关系为(填“>”、“=”、“<”、“无法比较”)。
(5)向绝热、恒容的密闭容器中通入H2、N2使其在一定条件下合成NH3,请在下图中画出平衡常数K随时间的变化曲线。
Ⅰ.短周期的5种主族元素A、B、C、D、E,原子序数依次增大。A、B、C三种元素原子电子层数之和是5;B原子的最外层电子数是其电子层数的2倍;D的一种单质是一种有特殊臭味的淡蓝色气体,可用于杀菌消毒;E与A在同一主族。请回答下列问题:
(1)写出A与E形成的化合物的电子式。
(2)B、D、E组成的一种盐中,B的质量分数为17.91%,其水溶液能使酸性高锰酸钾溶液褪色,写出该盐的化学式。
(3)写出工业制备单质E的化学方程式。
Ⅱ.某研究小组为了探究仅一种白色粉末状固体X(仅含四种元素)的组成和性质,称取6.3g固体X,设计并完成了如下实验:
已知:Cu2O+2H+=Cu+Cu2++H2O
请回答下列问题:
(1)画出沉淀丙中金属元素的原子结构示意图,写出气体甲的电子式。
(2)X的化学式是。
(3)生成砖红色沉淀的原因是(用化学方程式表示)。
(4)在加热条件下,用氢气还原砖红色沉淀,写出该反应的化学方程式,有人提出产物中可能还含有Cu2O,请设计实验方案验证之。
CO不仅是家用煤气的主要成分,也是重要的化工原料。工业上用简单有机物合成高分子涂料黏胶剂I的过程如下:
请回答下列问题:
(1)A的结构式。
(2)G分子中官能团名称是。
(3)写出反应①的化学方程式,指出②的反应类型。
(4)写出反应③的化学方程式。
NaHSO3被用于棉织物及有机物的漂白以及在染料、造纸、制革等工业中用作还原剂。
(1)NaHSO3可由NaOH溶液吸收SO2制得。
2NaOH(aq) + SO2(g) = Na2SO3(aq) + H2O(l),△H1
2NaHSO3(aq) = Na2SO3(aq) + SO2(g)+ H2O(l),△H2
则反应SO2(g) + NaOH(aq) = NaHSO3(aq) 的△H3 =(用含△H1、△H2式子表示);且△H1 ______△H2(填“>”、“<”和“=”)。
(2)NaHSO3在不同温度下均可被KIO3氧化,当NaHSO3完全消耗即有I2析出,根据I2析出所需时间可以求得NaHSO3的反应速率。将浓度均为0.020mol·L-1NaHSO3(含少量淀粉)10.0ml、KIO3(过量)酸性溶液40.0ml混合,记录10~55℃间溶液变蓝时间,55℃时未观察到溶液变蓝,实验结果如下左图。

①a点时,v(NaHSO3)=mol·L-1·s-1。
②根据图中信息判断反应:I2 +淀粉 蓝色溶液的△H0(填“>”、“<”或“=”)。
蓝色溶液的△H0(填“>”、“<”或“=”)。
③10-40℃区间内,显色时间越来越短,其原因是。
(3)已知:T℃时H2SO3的Ka1=1.5×10-2, Ka2=1.0×10-7;NaHSO3溶液pH<7。
在T℃时,往NaOH溶液中通入SO2。
①在NaHSO3溶液中加入少量下列物质后, 的值增大的是。
的值增大的是。
| A.H2O | B.稀H2SO4 | C.H2O2溶液 | D.NaOH溶液 |
②某时刻,测得溶液的pH=6,则此时, =。
=。
③请画出从开始通入SO2直至过量时,溶液中n(SO32-)∶n(HSO3-)随pH的变化趋势图。