对可逆反应4NH3(g)+5O2(g) 4NO(g)+6H2O(g),下列叙述正确的是( )
4NO(g)+6H2O(g),下列叙述正确的是( )
| A.反应达到平衡时,若两种反应物的转化率相等,则起始投入的n(NH3)∶n(O2)=4∶5 |
| B.反应达到平衡后,对体系一直进行加压,平衡总是逆向移动 |
| C.反应达到平衡时,若向压强固定的密闭容器中充入稀有气体,平衡不移动 |
| D.当v正(NH3)∶v正(NO)=1∶1时,说明该化学反应已经达到平衡 |
t℃时,水的离 子积为Kw,该温度下将a mol/L 一元酸 HA 与b mol/L一元碱BOH 等体积混合,若混合后溶液呈中性,下列说法一定正确的是()
子积为Kw,该温度下将a mol/L 一元酸 HA 与b mol/L一元碱BOH 等体积混合,若混合后溶液呈中性,下列说法一定正确的是()
A.混合液中,[H+] = |
B.混合液的pH = 7 |
| C.混合液中,c(B+)= c(A-)+ c(OH-) | D.a = b |
据报道,纳米Fe3 O4晶体材料可以作为核磁共振造影增强剂,用于疾病的诊断和作为药物载体用于疾病的治疗。其制备过程如图所示、下列叙述不合理的是()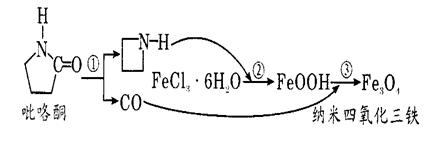
| A.Fe3O4可以表示为 FeO·Fe2O3,属于混合物 |
| B.反应③的化学方程式是:6FeOOH + CO ==2Fe3O4+3H2O+CO2 |
| C.纳米四氧化三铁分散在适当分散剂中,形成的分散系可能有丁达尔现象 |
D.在反应②环丙胺 的作用可能是促进氯化铁水解 的作用可能是促进氯化铁水解 |
设NA表示阿伏加德罗常数的值,下列叙述正确的是()
A.1L 0.1 mol·L-1的CH3COONa溶液中CH3COO -的总数是0.1NA -的总数是0.1NA |
| B.常温常压下,1.6g O2和O3混合气体中质子总数为0.8 NA |
| C.一定条件下,2mol SO2和 1mol O2发生反应,转移的电子总数一定是2NA |
| D.1L 0.1mol·L-1的葡萄糖溶液中分子总数为0.1 NA |
已知X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的转化关系如图所示(部分产物已略去)。则W、X不可能是
| 选项 |
W |
X |
| A |
盐酸 |
Na2CO3溶液 |
| B |
Cl2 |
Fe |
| C |
CO2 |
Ca(OH)2溶液 |
| D |
NaOH |
AlCl3溶液 |
膜技术原理在化工生产中有着广泛的应用。有人设想利用电化学原理制备少量硫酸和绿色硝化剂N2O5,装置图如下。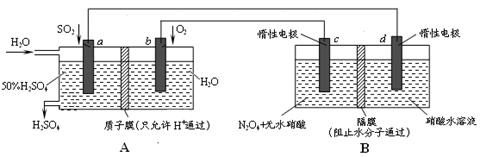
⑴A装置是________,B装置是_________(填“原电池”或“电解池”)。
⑵N2O5在电解池的______区生成,其电极反应式为_____________________________。
⑶通入O2一极的电极反应式为_______________________________。
⑷若通入SO2的速率为2.24 L·min-1(标准状况),为稳定持续生产,硫酸溶液的浓度应维持不变,则左侧水的流入速率应为_________mL·min-1。