已知25 ℃时部分弱电解质的电离平衡常数数据如下表:
| 弱酸化学式 |
HSCN |
CH3COOH |
HCN |
H2CO3 |
| 电离平衡常数 |
1.3×10-1 |
1.7×10-5 |
6.2×10-10 |
K1=4.3×10-7 K2=5.6×10-11 |
回答下列问题:
(1)写出碳酸的第一级电离平衡常数表达式:K1=____________。
(2)等物质的量浓度的a.CH3COONa、b.NaCN、c.Na2CO3、d.NaHCO3溶液的pH由大到小的顺序为 ________(填字母)。
(3)常温下,0.1 mol·L-1的CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是________(填序号)
A.[H+] B.[H+]/[CH3COOH] C.[H+]·[OH-] D.[OH-]/[H+]
(4)25 ℃时,将20 mL 0.1 mol·L-1 CH3COOH溶液和20mL0.1 mol·L-1HSCN溶液分别与20 mL 0.1 mol·L-1NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)的变化如图所示:
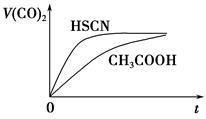
反应初始阶段
两种溶液产生CO2气体的速率存在明显差异的原因是________________________。
反应结束后所得两溶液中,c(CH3COO-)________c(SCN-)(填“>”、“<”或“=”)
(5)体积均为100 mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,
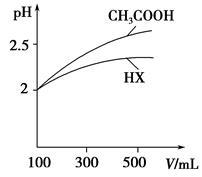
则HX的电离平衡常数________(填“大于”、“小于”或“等于”)CH3COOH的电离平衡常数。理由是:_________________________。
稀释相同倍数后,HX溶液中水电离出来的c(H+)________醋酸溶液水电离出来c(H+)(填“大于”、“等于”或“小于”)理由是______________________________;
(6)25 ℃时,在CH3COOH与CH3COONa的混合溶液中,若测得pH=6,则溶液中c(CH3COO-)-c(Na+)=________mol·L-1(填精确值),c(CH3COO-)/c(CH3COOH)=________。
(7)写出少量CO2通入次氯酸钠溶液中的离子方程式________________________。
某研究性学习小组对一包固体(为一种二元酸的正盐),进行相关实验,下表是该学习小组的部分实验报告。
(1)请根据实验现象,将你作出的判断填在表格内的相应位置。
| 步骤 |
操作 |
实验现象 |
结论 |
| ① |
取固体溶于水,得溶液X 加入几滴KSCN溶液 |
溶液X呈黄色,后呈现红色 |
X含有 ①(填离子符号) |
| ② |
取少量溶液X,加入氯化 钡溶液至不再生成沉淀,静置 |
上层溶液为黄色 生成白色沉淀 |
X可能含有__②(填离子符号) |
| ③ |
取②中生成白色沉淀,加入稀盐酸 |
沉淀不溶解 |
|
| ④ |
取②中上层溶液,加入硝酸银溶液 |
生成白色沉淀 |
X含有Cl- |
| 结论:此白色固体可能是③。 |
(2)你认为小明实验④中的结论对吗?如果不对,请说明理由。
,
(3)为了检验实验②中Cl-没有参加反应,还要进行的实验是(简要地写出实验操作过程及现象);写出反应的离子方程式。
下表中有三组物质,每组都有一种物质与其他三种物质属于不同类别。请选出该种物质,并把该物质和选择依据(与其他物质不同之处)列在下表相应的空格内。
| 序号 |
物质 |
被选出的物质 |
选择依据 |
| 1 |
O2、H2、Cl2、N2 |
||
| 2 |
Fe、Na、Al、C |
||
| 3 |
NaOH、CO2、H2SO4、Fe2(SO4)3 |
请从上述三组物质(也可为该物质的水溶液)中按要求任意选取物质一步完成下列反应的化学方程式或离子方程式:
⑴生成酸性氧化物的化合反应(化学方程式)
⑵生成沉淀的复分解反应(化学方程式)
⑶可用来制取84消毒液的反应(离子方程式)
⑷同种元素之间发生的既是离子反应又是氧化还原反应(离子方程式)
(8分)右图是Na、Cu、Si、H、C、N等元素单质的熔点高低的顺序,其中c、d均是热和电的良导体。
(1)单质a、f对应的元素以原子个数比1∶1形成的分子(相同条件下对H2的相对密度为13)中含________σ键和________个π键。
(2)a与b的元素形成的10电子中性分子X的空间构型为________;将X溶于水后的溶液滴入到AgNO3溶液中至过量,得到络离子的化学式为________,其中X与
Ag+之间以________键结合。
(3)右图是上述六种元素中的一种元素形成的含氧酸的结构:请简要说明该物质易溶于水的两个原因。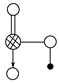
(4)氢键的形成对物质的性质具有一定的影响。 沸点。(填高或低)
沸点。(填高或低)
五种元素的原子电子层结构如下:
| A.1s22s1; |
| B.1s22s22p4; |
| C.1s22s22p6; |
| D.1s22s22p63s23p2 |
E.[Ar]3d104s1。
[用元素符号作答]
(1)元素的第一电离能最大的是 ;
(2)属于过渡元素的是 ;
(3)元素的电负性最大的是;
(4)上述元素之间能形成X2Y型化合物的化学式是 。
二氧化硒(Se)是一种氧化剂,其被还原后的单质硒可能成为环境污染物,通过与浓HNO3或浓H2SO4反应生成SeO2以回收Se。完成下列填空:
(1)Se和浓HNO3反应的还原产物为NO和NO2,且NO和NO2的物质的量之比为1:1。写出Se和浓HNO3的反应方程式。
(2)已知:Se+2H2SO4(浓) 2SO2↑+SeO2+2H2O
2SO2↑+SeO2+2H2O
2SO2+SeO2+2H2O Se+2SO42-+4H+
Se+2SO42-+4H+
SeO2、H2SO4(浓)、SO2的氧化性由强到弱的顺序是。
(3)回收得到的SeO2的含量,可以通过下面的方法测定:
①SeO2+KI+HNO3 Se+I2+KNO3+H2O(未配平)
Se+I2+KNO3+H2O(未配平)
②I2+2Na2S2O3 Na2S4O6+2NaI
Na2S4O6+2NaI
实验中,准确称量SeO2样品0.1500g,消耗0.2000 mol·L-1的Na2S2O3溶液25.00 mL,所测定的样品中SeO2的质量分数为。