已知常温下,浓度均为0.1 mol·L-1的4种钠盐溶液pH如下表:
| 溶质 |
Na2CO3 |
NaHCO3 |
NaClO |
NaHSO3 |
| pH |
11.6 |
9.7 |
10.3 |
5.2 |
下列说法中,正确的是( )
A.向氯水中加入NaHCO3,可以增大氯水中次氯酸的浓度
B.四种溶液中,水的电离程度最大的是NaClO
C.常温下,相同物质的量浓度的H2SO3、H2CO3、HClO,pH最大的是H2SO3
D.NaHSO3溶液中离子浓度大小顺序为c(Na+)>c(H+)>c(HSO3-)>c(SO32-)>c(OH-)
向某碳酸钠溶液中逐滴加1 mol·L─1的盐酸,测得溶液中Cl─、HCO3─的物质的量随加入盐酸体积的关系如图所示,其中n2:n1=3:2,则下列说法中正确的是 ( )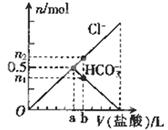
| A.Oa段反应的离子方程式与ab段反应的离子方程式相同 |
| B.该碳酸钠溶液中含有1mol Na2CO3 |
| C.b点的数值为0.6 |
| D.b点时生成CO2的物质的量为0.3 mol |
下列离子或分子在溶液中能大量共存,通CO2后仍能大量共存的一组是 ( )
| A.Mg2+、Fe3+、NO3-、SCN- | B.K+、Na+、Br-、SiO32- |
| C.K+、Ca2+、Cl-、NO3- | D.K+、Ag+、NH3·H2O、NO3- |
自然界地表层原生铜的硫化物经氧化、淋滤作用后变成CuSO4溶液,向地下层渗透,遇到难溶的ZnS或PbS,慢慢转变为铜蓝(CuS)。下列分析正确的是 ( )
| A.CuS的溶解度大于PbS的溶解度 |
| B.原生铜的硫化物具有还原性,而铜蓝没有还原性 |
| C.CuSO4与ZnS反应的离子方程式是Cu2++S2-= CuS↓ |
| D.整个过程涉及的反应类型有氧化还原反应和复分解反应 |
如图装置,将溶液A逐滴加入固体B中,下列叙述正确的是()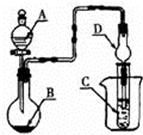
| A.若A为浓盐酸,B为MnO2,C中盛品红溶液,则C中溶液褪色 |
| B.若A为醋酸,B为贝壳,C中盛CaCl2溶液,则C中溶液变浑浊 |
| C.若A为浓硝酸,B为铜,C中盛KI−淀粉溶液,则C中溶液变蓝 |
| D.若A为浓硫酸,B为Na2SO3固体,C中盛石蕊试液,则C中溶液先变红后褪色 |
把V L含有MgSO4和K2SO4的混合溶液分成两等份,一份加入含a mol NaOH的溶液,恰好使镁离子完全沉淀为氢氧化镁;另一份加入含b mol BaCl2的溶液,恰好使硫酸根离子完全沉淀为硫酸钡。则原混合溶液中钾离子的浓度为( )
A.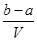 mol·L-1 mol·L-1 |
B.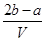 mol·L-1 mol·L-1 |
C.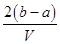 mol·L-1 mol·L-1 |
D.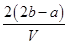 mol·L-1 mol·L-1 |