25℃时,Ksp(AgCl)=1.56×10﹣10,Ksp(Ag2CrO4)=9.0×10﹣12,下列说法正确的是( )
| A.向同浓度的Na2CrO4和NaCl混合溶液中滴加AgNO3溶液,AgCl先析出 |
| B.向AgCl饱和溶液中加入NaCl晶体,有AgCl析出且溶液中c(Ag+)=c(Cl﹣) |
C.AgCl和Ag2CrO4共存的悬浊液中, = = |
| D.向Ag2CrO4的悬浊液中加入NaCl浓溶液,Ag2CrO4不可能转化为AgCl |
某化合物6.4 g在O2中完全燃烧,只生成8.8 g CO2和7.2 g H2O。下列说法正确的是( )
| A.该化合物仅含碳、氢两种元素 | B.该化合物中碳氢原子个数比为1∶4 |
| C.无法确定该化合物是否含有氧元素 | D.无法确定该化合物的分子式 |
在一个容积为VL的密闭容器中放入2L A(g)和1L B(g),在一定条件下发生下列反应: 3A(g)十B(g) 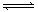 nC(g)+2D(g)达到平衡后,A物质的量浓度减小1/2,混合气体的平均摩尔质量增大1/8,则该反应的化学方程式中n的值是( )
nC(g)+2D(g)达到平衡后,A物质的量浓度减小1/2,混合气体的平均摩尔质量增大1/8,则该反应的化学方程式中n的值是( )
| A.1 | B.2 | C.3 | D.4 |
重水D2O的离子积为1.6×10-15,可以用pH一样的定义来规定pD="—lg" c(D+),以下关于pD的叙述正确的是( )
| A.中性溶液中pD=7 |
| B.在1L D2O的溶液中溶解0.01mol NaOD(设溶液的体积为1L),其中pD=12 |
| C.在1L D2O中溶解 0.01mol DCl(设溶液的体积为1L),其中pD=2 |
| D.在100mL 0.25mol·L-1的NaOD重水溶液中加入50mL 0.2mol·L-1DCl的重水溶液,其pD=1 |
在一定条件下,向5L密闭容器中充入2mol A气体和1mol B气体,发生可逆反应:2A(g)+B(g) 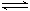 2C(g),达到平衡时容器内B的物质的量浓度为0.1mol/L,则A的转化率为( )
2C(g),达到平衡时容器内B的物质的量浓度为0.1mol/L,则A的转化率为( )
| A.67% | B.50% | C.25% | D.5% |
醋酸是一种常见的弱酸,为了证明醋酸是弱电解质,某同学开展了题为“醋酸是弱电解质的实验探究”的探究活动。该同学设计了如下方案,其中错误的是 ( )
| A.先配制一定量的0.10 mol/L CH3COOH溶液,然后测溶液的pH,若pH大于1,则可证明醋酸为弱电解质 |
| B.先配制一定量0.01 mol/L和0.10 mol/L的CH3COOH,分别用pH计测它们的pH,若两者的pH相差小于1个单位,则可证明醋酸是弱电解质 |
| C.取等体积、等pH的CH3COOH溶液和盐酸分别与足量锌反应,若测得反应过程中醋酸产生H2较慢且最终产生H2较多,则醋酸为弱酸 |
| D.配制一定量的CH3COONa溶液,测其pH,若常温下pH大于7,则可证明醋酸是弱电解质 |