在25℃时将pH=11 的NaOH 溶液与pH=3 的CH3COOH溶液等体积混合后,下列关系式中正确的是( )
| A.c (Na+)==c(CH3COO-)+c(CH3COOH) |
| B.c(H+)==c(CH3COO-)+c(OH一) |
| C.c (Na+) > c (CH3COO-)>c(OH-)>c(H+) |
| D.c (CH3COO-)>c(Na+)>c(H+)>c(OH-) |
下列事实,不能用勒夏特列原理解释的是( )
A.溴水中有下列平衡Br2+H2O HBr+HBrO,当加入AgNO3溶液后,溶液颜色变浅 HBr+HBrO,当加入AgNO3溶液后,溶液颜色变浅 |
B.对2HI(g) H2(g)+I2(g),平衡体系增大压强可使颜色变深 H2(g)+I2(g),平衡体系增大压强可使颜色变深 |
C.反应CO+NO2 CO2+NO(正反应为放热反应),升高温度可使平衡向逆反应方向移动 CO2+NO(正反应为放热反应),升高温度可使平衡向逆反应方向移动 |
| D.合成NH3反应为放热反应,为提高NH3的产率,理论上应采取低温的措施 |
已知0.1 mol/L的醋酸溶液中存在电离平衡:CH3COOH CH3COO-+H+,要使溶液中
CH3COO-+H+,要使溶液中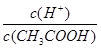 值增大,可以采取的措施是( )
值增大,可以采取的措施是( )
| A.加少量烧碱固体 | B.降低温度 | C.加少量冰醋酸 | D.加水 |
室温下,水的电离达到平衡H2O H++OH−。下列叙述正确的是( )
H++OH−。下列叙述正确的是( )
| A.加热,平衡向正反应方向移动,Kw不变 |
| B.向水中加入少量盐酸,平衡向逆反应方向移动,c(H+)增大 |
| C.向水中加入少量NaOH固体,平衡向逆反应方向移动,c(OH−)降低 |
| D.向水中加入少量CH3COONa固体,平衡向正反应方向移动,c(OH−)=c(H+) |
下列说法或表示方法正确的是( )
| A.等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出热量多 |
| B.在稀溶液中,H+(aq)+ OH−(aq)=H2O(l);△H=﹣57.3 kJ/mol,若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热量等于57.3 kJ |
| C.由C(石墨)=C(金刚石)△H="+1.90" kJ/mol可知石墨比金刚石稳定 |
| D.在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)=2H2O(g)△H=﹣571.6kJ/mol |
下列物质的水溶液能导电,但属于非电解质的是( )
| A.CH3COOH | B.SO2 | C.(NH4)2CO3 | D.Cl2 |