某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应:
A(g)+xB(g) 2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度随时间变化如下图所示。设35min和55min的平衡常数分别为K1、K2。
2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度随时间变化如下图所示。设35min和55min的平衡常数分别为K1、K2。

回答下列问题:
(1)反应方程式中的x= ;20min时的平衡常数 K = 。
(2)8min时A的转化率为 。
(3)30min时改变的条件是 。
(4)若40min时改变的条件是升高温度,则K1 K2(填“>”或“<”或“=”, 下同)。
(5)能判断反应A(g)+xB(g) 2C(g),达到化学平衡状态的依据是 (填序号)。
2C(g),达到化学平衡状态的依据是 (填序号)。
A.恒容容器中压强不变 B.混合气体中c(A)不变
C.2v正(A)= v逆(C) D.2c(A)= c(C)
用0.1320mol/L的HCl溶液滴定未知浓度的NaOH溶液,实验数据如下表所示,
| 实验编号 |
待测NaOH溶液体积/mL |
HCl溶液体积/mL |
| 1 |
25.00 |
24.41 |
| 2 |
25.00 |
24.39 |
| 3 |
25.00 |
24.60 |
回答下列问题:
(1)图中甲为滴定管(填“酸式”或“碱式”)
(2)①配制标准盐酸时,不需要用到的仪器是________;
A.托盘天平
B.容量瓶
C.酸式滴定管
D.量筒
E.烧杯
F.胶头滴管
G.玻璃棒
②滴定操作中,眼睛要___________________。
(3)取待测液NaOH溶液25.00mL 于锥形瓶中,使用酚酞做指示剂。滴定终点的判断依据是_________
(4)若酸式滴定管不用标准盐酸润洗,将使所测结果(填“偏高”“偏低”“不变”,下同);若读数时,滴定前仰视,滴定后正确读数,则所测结果。
(5)未知浓度的NaOH溶液的物质的量浓度为mol/L。
(10分)Ⅰ、可逆反应:aA(g) + bB(g) cC(g) + dD(g);根据图回答:
cC(g) + dD(g);根据图回答: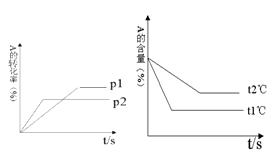
①压强 P1P2;(a +b)(c +d)(填“>”或“<”下同)。
②温度t1℃t2℃;△H0。
③保持体积和温度不变,通入He,平衡会____移动(填“正向”、“逆向”或“不”)。
Ⅱ、写出下列元素基态原子的电子排布式:
①29Cu
②32Ge(简式)
(11分)(1)常温下,0.10 mol·L-1 NH4Cl溶液pH______7(填“>”、“=”或“<”)。
(2)相同物质的量浓度的Na2CO3溶液与NaHCO3溶液,pH大小:Na2CO3________NaHCO3(填“>”、“=”或“<”)。
(3)在配制FeCl3溶液时,应加入__________,目的是_____________。
(4)Na2S溶液中滴入酚酞溶液显______色,原因是__________________。(用离子方程式表示),
(5)将氯化铝溶液蒸干并灼烧得到的固体物质是;(填化学式,下同)将硫酸铝溶液蒸干得到的固体物质是。
(10分)Ⅰ、在A、B、C三个烧杯中分别盛有相同浓度的稀硫酸,如图所示:
①A中反应的离子方程式为:_______________________________。
②B中Sn极附近溶液的pH________(填“增大”、“减小”或“不变”)。
③比较A、B、C中铁被腐蚀的速率,由快到慢的顺序是________________。
Ⅱ、如图所示,甲、乙两池电极材料都是铁棒和碳棒,请回答下列问题: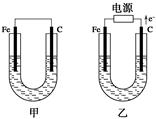
(1)若两池中电解质溶液均为CuSO4溶液,则反应一段时间后:
①有红色物质析出的是甲池中的________棒。
②乙池中阳极的电极反应式是___________________。
(2)若两池中电解质溶液均为饱和NaCl溶液:
①甲池中碳棒上电极反应式是_____________________,
②乙池电解一段时间后,测知溶液体积为200ml,PH=13,则阴极生成的气体在标准状况下体积是______L。
有一包白色粉末,可能是CuSO4、CaCO3、BaCl2、Na2SO4、KOH中的一种或几种,为证明其组成,进行如下实验:
(1)取少量白色粉末,向其中加入足量的水,充分搅拌后过滤,得到白色沉淀和无色滤液,则白色沉淀可能是,原混合物中一定不含有;
(2)向实验(1)滤出的白色沉淀中加入足量的盐酸,沉淀全部溶解,并产生无色气体。则原混合物中一定含有。 该反应的离子方程式为;
(3)将实验(1)中得到的滤液分成两份,将实验(2)中产生的无色气体先通入其中的一份,无沉淀产生。气体导出后再通入另一份滤液中,立即产生白色沉淀,再过滤。出现上述现象的原因是实验(2)中产生的气体里含有 。
(4)向实验(3)中过滤后所得的滤液里加入AgNO3溶液和稀硝酸,又产生白色沉淀,根据此现象推断,原混合物中一定还含有,根据实验全过程推断,原混合物中还含有。