某区域内存在着电场,电场线在竖直平面内的分布如图所示,一个质量为m、电荷量为q的小球在该电场中运动,小球经过A点时的速度大小为vl,方向水平向右,运动至B点时的速度大小为v2,运动方向与水平方向之间的夹角为α,A、B两点之间的高度差与水平距离均为H,则以下判断中正确的是( )
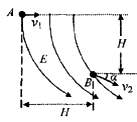
A.若v2>vl,则电场力一定做正功
B.A、B两点间的电势差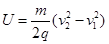
C.小球运动到B点时所受重力的瞬时功率P=mgv2
D.小球由A点运动到B点,电场力做的功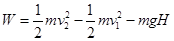
如图所示,在xOy平面内有一个以O为圆心、半径R=0.1m的圆,p为圆周上的一点,O、p两点连线与 轴正方向的夹角为θ。若空间存在沿y轴负方向的匀强电场,场强大小E=100V/m,则O、p两点的电势差可表示为()
轴正方向的夹角为θ。若空间存在沿y轴负方向的匀强电场,场强大小E=100V/m,则O、p两点的电势差可表示为()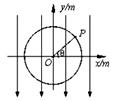
A.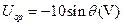 |
B.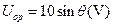 |
C. |
D.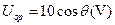 |
如图所示,纵坐标表示两个分子间引力、斥力的大小,横坐标表示两个分子的距离,图中两条曲线分别表示两分子间引力、斥力的大小随分子间距离的变化关系,e为两曲线的交点,则下列说法正确的是()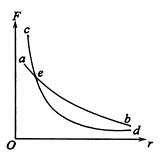
| A.ab为引力曲线,cd为斥力曲线,e点横坐标的数量级为10-10m |
| B.ab为斥力曲线,cd为引力曲线,e点横坐标的数量级为10-10m |
C.若两个分子间距离大于e 点的横坐标,则分子间作用力表现为斥力 点的横坐标,则分子间作用力表现为斥力 |
| D.若两个分子间距离越大,则分子势能亦越大 |
在地面上某处将一金属小球竖直向上抛出,上升一定高度后再落回原处。若不考虑空气阻力,则下列图象能正确反映小球的速度v、加速度a、位移x和动能Ek随时间变化关系的是(取向上为正方向)()
某校中学生参加电视台“异想天开”节目的活动,他们提出了下列四个设想方案。从理论上讲可行的是()
| A.制作一个装置从海水中吸收内能全部用来做功而不产生其它影响 |
| B.制作一种制冷设备,使温度降至绝对零度以下 |
| C.汽车尾气中各类有害气体排入大气后严重污染空气,想办法使它们自发地分离,既清洁了空气,又变废为宝 |
| D.在房屋顶上装太阳能板,可直接用太阳能来解决照明和热水问题 |
在水平地面上一名滑板运动员双脚站在滑板上以一定速度向前滑行,在横杆前起跳并越过杆,从而使人与滑板分别从杆的上下通过。如图所示,假设人和滑板运动过程中受到的各种阻力忽略不计,运动员能顺利完成该动作,最终仍落在滑板原来的位置上,要使这个表演成功,运动员除了跳起的高度足够外,在起跳时双脚对滑板作用力的合力方向应该()
| A.竖直向上 | B.竖直向下 |
| C.向下适当偏后 | D.向上适当偏前 |