常温下,下列有关醋酸溶液的叙述中不正确的是
| A.pH=4.3的CH3COOH与CH3COONa混合溶液中:c(Na+)<c(CH3COO-) |
| B.浓度为0.2mol/L的CH3COOH溶液和浓度为0.1mol/L的NaOH溶液等体积混合后: c(CH3COO-)-c(CH3COOH)=2[c(H+)-c(OH-)] |
C.醋酸浓溶液加少量水稀释, 几乎不变 几乎不变 |
| D.amol/LCH3COOH溶液与bmol/LNaOH溶液等体积混合,所得溶液中c(Na+)>c(CH3COO-),则一定有a≤b |
化学与生产、生活息息相关,下列叙述错误的是()
| A.碱性锌锰干电池比普通锌锰干电池性能好,比能量和可储存时间均有提高 |
| B.汽车加大油门、把食物放在冰箱里,食品包装袋内放置小包除氧剂,都是为了改变反应物转化率而采取的措施 |
| C.1kg人体脂肪可存储约32200kJ能量,一般人每行走1km大约要消耗170kg能量,如果每天步行5kg,一年(按365天计)中消耗的脂肪大约是9.6kg |
| D.炒菜用铁锅未及时洗净(残余中含NaCl),可能发生电化学腐蚀生成红褪色锈斑 |
在恒容密闭容器中加入一定量的X并发生反应:2X(g) Y(g),在温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示。下列叙述正确的是
Y(g),在温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示。下列叙述正确的是
| A.该反应进行到N点放出的热量大于进行到W点放出的热量 |
B.T2下,在0 ~t1时间内,c(Y)=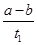 mol·L-1·min-1 mol·L-1·min-1 |
| C.W点的正反应速率V正大于N点的逆反应速率V逆 |
| D.W点时再加入一定量X,再达平衡后X的转化率减小 |
恒温恒容条件下,可逆反应 达到平衡,下列叙述不是反应达到平衡的标志
达到平衡,下列叙述不是反应达到平衡的标志
① C的生成速率与C的分解速率相等
② 单位时间生成amolA,同时生成3amolB
③ A、B、C的浓度均不再变化
④ A、B、C的物质的量之和不再变化
⑤ 混合气体的总压强不再变化
⑥ 混合气体的密度不再变化
⑦ 单位时间内消耗a molA,同时生成3a molB
⑧ A、B、C的物质的量之比为1︰3︰2
A.⑤⑥⑧ B.③④⑦ C.①③⑥ D.②⑥⑧
700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:
CO(g)+ H2O(g) CO2 (g)+ H2(g)
CO2 (g)+ H2(g)
反应过程中测定的部分数据见下表(表中t2>t1):
| 反应时间/min |
n(CO)/mol |
n(H2O)/mol |
| 0 |
1.20 |
0.60 |
| t1 |
0.80 |
|
| t2 |
0.20 |
下列说法正确的是
A.反应在t1min内的平均速率为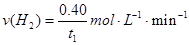
B.保持其他条件不变,起始时向容器中充入0.60molCO和1.20 molH2O,到达平衡时n(CO2)= 0.40mol
C.保持其他条件不变,向平衡体系中再通入0.20molH2O,与原平衡相比,达到新平衡时H2O转化率增大
D.温度升至800℃,上述反应平衡常数为0.64,则正反应为吸热反应
室温下向10mL pH=3的醋酸溶液中加入10mL水稀释后,下列说法正确的是
| A.溶液中导电粒子的数目减少 |
B.溶液中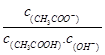 不变 不变 |
| C.醋酸的电离程度增大,c(H+)亦增大 |
| D.再加入10mlpH=11的NaOH溶液,混合溶液pH=7 |