利用右图所示装置进行下列实验,能得出相应实验结论的是
| 选项 |
① |
② |
③ |
实验结论 |
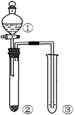 |
| A |
浓硫酸 |
Cu |
KMnO4溶液褪色 |
SO2有漂白性 |
|
| B |
浓盐酸 |
MnO2 |
FeBr2溶液变为黄色 |
氧化性:Cl2 >Br2 |
|
| C |
稀硫酸 |
碳酸钠 |
CaCl2溶液无明显变化 |
CO2不与CaCl2溶液反应 |
|
| D |
浓硫酸 |
蔗糖 |
溴水褪色 |
浓硫酸具有脱水性、吸水性 |
调查发现,某些新装修的居室中空气污染物浓度过高,对人体健康产生一定影响。这些污染物最常见的是
| A.二氧化硫 | B.二氧化碳 | C.乙烯 | D.甲醛、苯、醚等挥发性有机物 |
光导纤维的主要成分是
| A.纯硅 | B.玻璃 | C.SiO2 | D.沙子 |
下列关于食品添加剂的说法不正确的是
| A.亚硝酸钠可以致癌 | B.我们应该禁止使用防腐剂 |
| C.苯甲酸钠可以用作防腐剂 | D.绝大多数食品添加剂在过量使用时对人体有害的 |
关于合理饮食有利于健康的下列说法正确的是
| A.没有水就没有生命 | B.调味剂和营养剂加得越多越好 |
| C.饮用水越纯净越好 | D.养成良好的饮食习惯,多吃蔬菜、水果等碱性食物 |
根据生命元素在人体中含量的高低可分为常量元素和微量元素。下列元素中,属于微量元素的是
| A.H | B.N | C.O | D.Cu |