富铁铝土矿(主要含有A12O3、Fe2O3、FeO和SiO2)可制备新型净水剂液体聚合硫酸铝铁[AlaFeb(OH)m(SO4)n]。研究发现,当a=b时净水效果最好。工艺流程如下(部分操作和产物略):
(1)A12O3与H2SO4发生反应的离子方程式是____________。
(2)测得滤液中 。加入FeSO4·7H2O和H2O2的作用是(结合化学用语说明)____________。
。加入FeSO4·7H2O和H2O2的作用是(结合化学用语说明)____________。
(3)将溶液A电解得到液体聚合硫酸铝铁。装置如图所示(阴离子交换膜只允许阴离子通过,电极为惰性电极)
① 阴极室的电极反应式是__________。
② 电解过程阳极室溶液pH的变化是____________(填“增大”、“减小”或“不变”)。
③ 简述在反应室中生成液体聚合硫酸铝铁的原理____________。
Ⅰ.下面列出了几组物质或粒子,请将合适的组号填写在空格上。
①金刚石与“足球烯”(C60);②D与T;③16O、17O和18O;④氧气(O2)与臭氧(O3);⑤乙醇(CH3CH2OH)和甲醚(CH3OCH3);
(1)是同素异形体的, (2)是同位素的,(3)是同分异构体的。
Ⅱ.在下列变化中:①干冰气化 ②硝酸钾熔化 ③食盐溶于水 ④HCl溶于水 ⑤蔗糖溶于水 ⑥HI分解。用序号填空:(1)未破坏化学键的是,(2)仅离子键被破坏的是,
(3)仅共价键被破坏的是。
从海水制备金属镁的流程如图所示: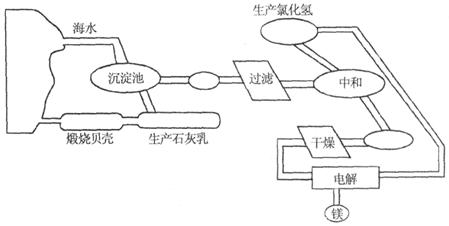
(1)为了节约成本,充分利用海滩资源,用贝壳经过一系列反应可以制得石灰乳,请写出有关反应的化学方程式:__________;__________。
(2)向石灰乳中加入MgCl 溶液,充分搅拌、过滤、洗涤。写出该反应的化学方程式:__________。
溶液,充分搅拌、过滤、洗涤。写出该反应的化学方程式:__________。
(3)从熔点与硬度方面来看,镁合金与镁相比较,其特点有__________。
已知A的产量通常用来衡量一个国家的石油化工水平,现以A为主要原料合成一种具有果香味的物质E,其合成路线如下图所示。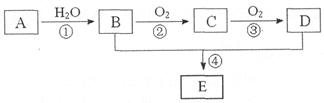
请回答下列问题:
(1)写出A的结构简式__________,B、D分子中的官能团名称分别是__________、__________。
(2)写出下列反应的化学方程式,并注明反应类型:
②____________________,____________________;
④____________________,____________________。
(3)在实验室利用B和D制备E的实验中,若用1mol B和1 mol D充分反应,能否生成1mol E?__________,原因是__________。
在下列事实中,什么因素影响了化学反应的速率?
(1)黄铁矿煅烧时要粉碎成细小的矿粒:________;
(2)熔化的KClO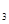 放出气泡很慢,加入少量MnO
放出气泡很慢,加入少量MnO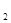 很快产生气体:________;
很快产生气体:________;
(3)同浓度、同体积的盐酸中放入大小相同的铁片和镁片产生气体有快有慢:________;
(4)同样大小的石灰石分别在0.1mol/L的盐酸和1mol/L的盐酸中反应速率不同:________________;
(5)夏天的食品易霉变,冬天就不易发生类似现象:________。
周期表中短周期6种元素A、B、C、D、E、F,原子序数依次增大。A的原子半径最小,A和D、C和F分别同主族,F的单质是黄色固体,B所形成的化合物种类最多,E的最外层电子数等于其电子层数。
(1)写出工业制备E单质的化学方程式____________________。
(2)写出一种由其中两种元素组成的既含极性键又含非极性键的18电子微粒________(写化学式)。
(3)由A、C元素组成的化合物甲与由D、C元素组成的化合物乙反应可制备O2,请写出乙的电子式__________。
(4)3mol DABC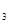 和2mol D
和2mol D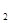 C
C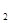 混合,在密闭容器中加热使之充分反应,然后趁热排出气体物质,容器内残留物的成分及物质的量分别是____________________。
混合,在密闭容器中加热使之充分反应,然后趁热排出气体物质,容器内残留物的成分及物质的量分别是____________________。