氰氨化钙是一种重要的化工原料,其制备的化学方程式为:
CaCO3+2HCN=CaCN2+CO↑+H2↑+CO2↑,下列说法正确的是
| A.CO为氧化产物,H2为还原产物 | B.CaCN2含有共价键,属于共价化合物 |
| C.HCN既是氧化剂又是还原剂 | D.每消耗10g CaCO3生成2.24L CO2 |
下表所示为部分短周期元素的原子半径及主要化合价,根据表中信息判断以下叙述正确的是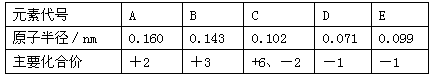
A.A、B的单质与稀盐酸反应速率B>A
B.D、E形成的简单离子的还原性E->D-
C.气态氢化物的稳定性HD<H2C
D.最高价氧化物对应的水化物的酸性 H2CO4>HEO4
下列图示与对应的叙述一定正确的是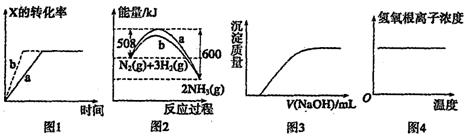
A.图1所示反应:X(g)+Y(g) 2Z(g),b的压强一定比a大 2Z(g),b的压强一定比a大 |
| B.图2表明合成氨反应是放热反应,b表示在反应体系中加入了催化剂 |
| C.图3表示向Ca(HCO3)2溶液中滴入NaOH溶液所得沉淀的质量变化 |
| D.图4表示明矾溶液受热时氢氧根浓度随温度的变化 |
下列解释事实或实验现象的化学用语正确的是
A.向沸水中滴加饱和FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O Fe(OH)3↓+ 3H+ Fe(OH)3↓+ 3H+ |
| B.酸性KI淀粉溶液久置后变蓝4I-+O2+2H2O=2I2+4OH- |
| C.实验室盛装NaOH溶液的试剂瓶不能用玻璃塞SiO2+2OH- = SiO32-+H2O |
| D.钢铁表面的水膜酸性较强时,水膜中的H+会被还原O2+4H++4e- = 2H2O |
已知:2H2(g) +O2(g) = 2H2O(g)ΔH =-483.6 kJ/mol 
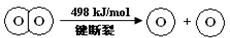
下列说法不正确的是
| A.H2(g) 中的H—H 键比H2O(g) 中的H—O 键牢固 |
| B.H2O(g)=H2(g) + 1/2O2(g)ΔH =" +241.8" kJ/mol |
| C.破坏1 mol H—O 键需要的能量是463.4 kJ |
| D.H2(g) + 1/2O2(g)=H2O(l)ΔH <-241.8 kJ/mol |
在15.2g铁和铜组成的合金中加入过量的硝酸溶液,合金完全溶解,同时生成气体X,再向所得溶液中加入足量的NaOH溶液,生成25.4g沉淀,则下列表示气体X组成的选项中合理的是
| A.0.3 mol NO、0.1 mol NO2 |
| B.0.3 mol NO2、0.1 mol NO |
| C.0.6 mol NO |
| D.0.3 mol NO2 |