下列关于 0.2 mol/L 硝酸钾溶液的叙述中,正确的是( )
| A.1 L 该溶液中含硝酸钾 202 g |
| B.100 mL 该溶液中含硝酸钾 0.02 mol |
| C.从 1 L 该溶液中取出 500 mL 后,剩余溶液的浓度为 0.1 mol/L |
| D.1 L 水中溶解 0.2 mol 硝酸钾,即可配得 0.2 mol/L 硝酸钾溶液 |
现有1.0 mol/L的NaOH溶液0.1L,若通入标准状况下体积为2.24L 的SO2气体,使其充分反应后,则所得溶液中各粒子浓度大小关系正确的是
| A.c(Na+)+c(H+) = c(HSO3―) +c(SO32―) + c( OH―) |
| B.c(Na+) = c(H2SO3) + c(HSO3―) + c ( H+) |
| C.c(SO32―) + c( OH―) = c(H+) + c(H2SO3) |
| D.c(Na+)>c(HSO3―)>c( OH―)>c(H2SO3)>c(SO32―)>c(H+) |
把固体Ca(OH)2放入蒸馏水中达到溶解平衡后:Ca(OH)2(s) Ca2+ (aq)+ 2OH-(aq),下列说法中正确的是
Ca2+ (aq)+ 2OH-(aq),下列说法中正确的是
| A.给溶液加热,溶液中的Ca2+浓度一定增大 |
| B.恒温条件下向溶液中加入少量CaO,溶液的pH升高 |
| C.向溶液中加入少量CH3COONa晶体,则Ca(OH)2固体的质量增多 |
| D.向溶液中加入少量冰醋酸,溶液中的OH-浓度增大 |
与pH类似,我们定义pOH=-lgc(OH-),下列溶液,一定呈中性的是
| A.c(H+)=1×10-7mol·L-1的溶液 | B.水电离的H+和OH-浓度相等的溶液 |
| C.pH+pOH=14的溶液 | D.pH=pOH的溶液 |
在密闭容器中进行以下可逆反应:A(g)+B(g)  C(g)+2D(?),在不同的条件下C的百分含量的变化情况如图,则该反应描述正确的是
C(g)+2D(?),在不同的条件下C的百分含量的变化情况如图,则该反应描述正确的是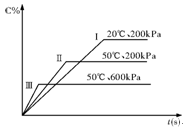
| A.正反应放热,D是固体 |
| B.正反应放热,D是气体 |
| C.正反应吸热,D是气体 |
| D.正反应放热,D是固体或气体 |
如图是关于N2+3H2 2NH3 ΔH<0的速率—时间图象,则t1时刻使平衡发生移动的原因是
2NH3 ΔH<0的速率—时间图象,则t1时刻使平衡发生移动的原因是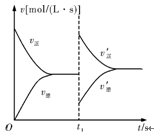
| A.升高温度,同时增大压强 |
| B.降低温度,同时减小压强 |
| C.增大反应物的浓度,同时使用适宜的催化剂 |
| D.增大反应物的浓度,同时减小生成物的浓度 |