下列图示与对应的叙述相符的是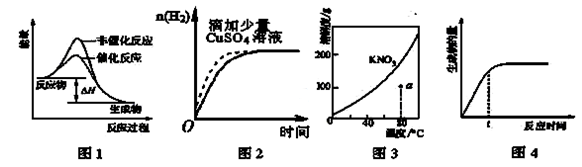
| A.图1表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化 |
| B.图2表示常温下,等量锌粉与足量的等浓度的盐酸反应(滴加CuSO4溶液的为虚线) |
| C.图3表示 KNO3 的溶解度曲线,a点所示的溶液是80℃时KNO3的不饱和溶液 |
| D.图4表示某可逆反应生成物的量随反应时间变化的曲线,t时反应物转化率最大 |
某温度下,反应SO2(g)+ 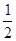 O2(g)
O2(g)  SO3 (g) 的平衡常数K1=50,在同一温度下,反应2SO3(g)
SO3 (g) 的平衡常数K1=50,在同一温度下,反应2SO3(g)  2SO2(g) + O2(g)的平衡常数K2的值为()
2SO2(g) + O2(g)的平衡常数K2的值为()
| A.2500 | B.100 | C.4×10-4C | D.2×10-2 |
某温度时,一定压强下的密闭容器中发生反应:aX(g)+bY(g) 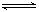 cZ(g)+dW(g),达平衡后,保持温度不变压强增大至原来的2倍,当再达到平衡时,W的浓度为原平衡状态的1.8倍,下列叙述正确是()
cZ(g)+dW(g),达平衡后,保持温度不变压强增大至原来的2倍,当再达到平衡时,W的浓度为原平衡状态的1.8倍,下列叙述正确是()
| A.平衡正移 | B.(a+b)>(c+d) |
| C.Z的体积分数变小 | D.X的转化率变大 |
在一定温度下,容器内某一反应中M、N的物质的量随反应时间的变化曲线如图,下列表述中正确的是()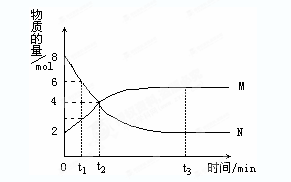
A.反应的化学方程式为:2M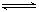 N N |
B.t2时,正逆反应速率相等,达到平衡 |
| C.t3时,正反应速率大于逆反应速率 | D.t1时,N的浓度是M浓度的2倍 |
某温度时,浓度都是1mol·L-1的两种气体,X2、Y2在密闭容器中反应生成气体Z,达到平衡时c(X2)=0.4mol·L-1、c(Y2)=0.8mol·L-1、c(Z)=0.4mol·L-1,则该反应的反应式是()
A.X2+2Y2 2XY2 2XY2 |
B.2X2+Y2 2X2Y 2X2Y |
C.3X2+Y2 2X3Y 2X3Y |
D.X2+3Y2 2XY3 2XY3 |
已知:(1)Zn(s)+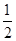 O2(g)===ZnO(s),ΔH=" -348.3" kJ·mol-1,
O2(g)===ZnO(s),ΔH=" -348.3" kJ·mol-1,
(2)2Ag(s)+ 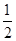 O2(g)===Ag2O(s),ΔH=" -31.0" kJ·mol-1,则Zn(s)+ Ag2O(s) ===ZnO(s)+ 2Ag(s)的ΔH等于()
O2(g)===Ag2O(s),ΔH=" -31.0" kJ·mol-1,则Zn(s)+ Ag2O(s) ===ZnO(s)+ 2Ag(s)的ΔH等于()
| A.-317.3 kJ·mol-1 | B.-379.3 kJ·mol-1 | C.-332.8 kJ·mol-1 | D.317.3 kJ·mol-1 |