向Na2CO3、NaHCO3混合溶液中逐滴加入稀盐酸,生成气体的量随盐酸加入量的变化关系如下图所示。则下列离子组在对应的溶液中,一定能大量共存的是( )
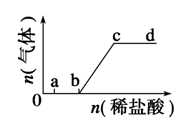
| A.a点对应的溶液中:Na+、OH-、SO42—、NO3— |
| B.b点对应的溶液中:Al3+、Fe3+、SCN-、Cl- |
| C.c点对应的溶液中:Na+、Ca2+、NO3—、Cl- |
| D.d点对应的溶液中:Fe2+、Na+、Cl-、NO3— |
利用下列实验装置能完成相应实验的是
| A.图1装置制取少量乙酸乙酯 | B.图2装置制取并吸收HCl |
| C.图3装置量取8.5mL的稀硫酸 | D.图4装置模拟铁的腐蚀 |
下列有关物质的分类或归类不正确的是
①混合物:石炭酸、福尔马林、水玻璃、水银②化合物:CaCl2、烧碱、苯乙烯、HD
③电解质:明矾、胆矾、冰醋酸、硫酸钡④纯净物:干冰、冰水混合物、浓硫酸、水晶
⑤同位素:C、C、C⑥同系物:CH2O2、C2H4O2、C3H6O2、C4H8O2
A.①②④⑥ B.①②④⑤ C.①③④⑤ D.②④⑤⑥
向X的溶液中加入Y试剂,产生的沉淀示意图与下图所示情形吻合的是(注意线段的斜率)
| A.向NaOH和Ca(OH)2的混合溶液中通入CO2 | B.向HCl和AlCl3的混合溶液中滴加NaOH |
| C.向NH4Al(SO4)2溶液中滴加NaOH | D.向NH4Cl和MgCl2的混合溶液中滴加NaOH |
已知25℃时,有关弱酸的电离平衡常数:
| 弱酸 |
CH3COOH |
HCN |
H2CO3 |
| 电离平衡常数 |
1.8×10-5 |
4.9×10-10 |
Ka1=4.3×10-7Ka2=5.6×10-11 |
则下列有关说法不正确的是
A.25℃时,0.1mol·L-1溶液的pH关系为:pH(NaCN)>pH(Na2CO3)>pH(CH3COONa)
B.25℃时,pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,c(H+)相等
C.25℃时,同浓度的醋酸和氢氧化钠等体积混合,所得溶液pH=8,则c(Na+)-c(CH3COO-)=9.9×10-7
D.NaHCO3和Na2CO3混合溶液中,一定有c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-)
为测定人体血液中Ca2+的含量,设计了如下方案:
有关反应的化学方程式为:2KMnO4+5H2C2O4+3H2SO4K2SO4+2MnSO4+10CO2↑+8H2O
若血液样品为15mL,滴定生成的草酸消耗了0.001mol·L-1的KMnO4溶液15.0mL,则这种血液样品中的含钙量为
| A.0.001mol·L-1 | B.0.0025mol·L-1 | C.0.0003mol·L-1 | D.0.0035mol·L-1 |