如图是CO2电催化还原为CH4的工作原理示意图。下列说法不正确的是( )
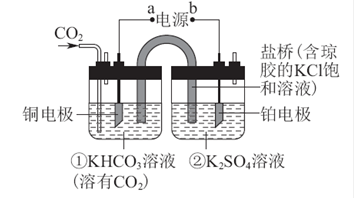
| A.该过程是电能转化为化学能的过程 |
| B.一段时间后,①池中n(KHCO3)不变 |
| C.一段时间后,②池中溶液的pH 一定下降 |
| D.铜电极的电极反应式为CO2+8H++8e-=CH4+2H2O |
影响活化分子的百分数的因素有()
①温度②浓度③压强④催化剂⑤接触面积
A①② B、①②③④ C、①④ D、②④
在2A+B  3C+4D反应中,表示该反应速率最快的是 ( )
3C+4D反应中,表示该反应速率最快的是 ( )
A.v(A)=5 mol·L-1·min-1 B.v(B)=0.3 mol·L-1·s-1
C.v(C)=0.8 mol·L-1·s-1 D.v(D)=10 mol·L-1·min-1
在一定条件下,在体积为2L的密闭容器中发生反应:mA + nB=pC。t秒末,A减少了1 mol,B减少了1.25  mol,C增加了0.25 mol/L。则m ∶ n ∶ p应为()
mol,C增加了0.25 mol/L。则m ∶ n ∶ p应为()
A.4∶ 5∶ 2 B.2∶ 5∶ 4 C.1∶ 3∶ 2 D.3∶ 2∶ 1
设C(g)+CO2(g)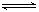 2CO(g) △H>0 ,反应速率为 u1,N2+3H2
2CO(g) △H>0 ,反应速率为 u1,N2+3H2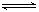 2NH3 △H<0反应速率为 u2,对于上述反应,当温度升高时,u1和u2的变化情况为()
2NH3 △H<0反应速率为 u2,对于上述反应,当温度升高时,u1和u2的变化情况为()
| A.同时增大 | B.同时减小 | C.增大,减小 | D.减小,增大 |
用物质的量都是0.1mol的HCN和NaCN混合后配成1L溶液,已知溶液中的c(CN-)<c(Na+),下列关系式正确的是( )
| A.c(H+)>c(OH-) | B.c(HCN)<c(CN-) |
| C.c(CN-)+c(OH-)=0.1mol·L-1 | D.c(HCN)+c(CN-) =0.2mol·L—11 |