(1)FeCl3的水溶液呈____________(填“酸”“中”或“碱”)性,原因是__________(用离子方程式表示):;实验室在配制.FeCl3溶液时,常将FeCl3固体先溶于较浓的盐酸中,然后再用蒸馏水稀释到所需的浓度,以________(填“促进”或“抑制”)其水解
(2)25 °C时,0.1 mol·L-1NH4Cl溶液的pH__________7(填“<”、“=”或“>”),其原因是__________________(用离子方程式表示);
(3)泡沫灭火器灭火原理____________________(用离子方程式表示)
(4)纯碱可代替洗涤剂洗涤餐具,原因是________________(用离子方程式表示):.
FeCl3溶液棕黄色,对此溶液,分别做如下实验,请填表:
| 编号 |
实践操作 |
实验主要现象 |
离子方程式 |
| ① |
加入过量 铁粉 |
||
| ② |
加入少量Na2O2粉末 |
||
| ③ |
加入少量AgNO3溶液 |
(1)氢氧化铝Al(OH)3是一种治疗胃酸(含盐酸)过多的药物,用化学方程式表示该反应的原理.
(2)NaHCO3是制作糕点的常用疏松剂,写出NaHCO3受热分解的化学方程式
(3)取少量Fe2O3粉末(红棕色)加入适量盐酸,该反应的离子方程式为;用此溶液进行以下反应,取少量溶液于一支试管中,滴入NaOH溶液,可观察到有红褐色沉淀生成,反应的离子方程式为。
在一定条件下,二氧化硫和氧气发生如下反应:
2SO2(g)+O2(g)  2SO3(g) ΔH<0
2SO3(g) ΔH<0
(1)降低温度,该反应K值_____,二氧化硫转化率____,化学反应速率______。(以上均填“增大”“减小”或“不变”)
(2) 600 ℃时,在一密闭容器中,将二氧化硫和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图所示,反应处于平衡状态的时间有。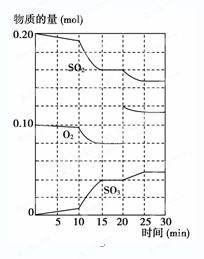
(3) 据上图判断,反应进行至20 min时,曲线发生变化的原因是___________(用文字表达);10 min到15 min的曲线变化的原因可能是________(填写编号)。
a.加了催化剂 b.缩小容器体积
c.降低温度 d.增加SO3的物质的量
2SO2(g)+O2(g)  2SO3(g)反应过程的能量变化如图所示。
2SO3(g)反应过程的能量变化如图所示。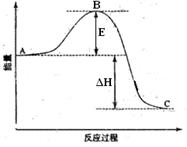
已知1mol SO2(g)氧化为1mol SO3的ΔH=-99kJ·mol-1.请回答下列问题:
(1)图中C表示;该反应通常用V2O5作催化剂,加V2O5会使图中B点降低,理由是;
(2)图中△H=kJ·mol-1;
(3)如果反应速率υ(SO2)为0.05 mol·L-1·min-1,则υ(O2)=mol·L-1·min-1;
(4)已知单质硫的燃烧热为296 KJ·mol-1,计算由S(s)生成3 molSO3(g)的△H=。
如图为一“铁链”图案,小明在图案上分别写了H2、CO2、Na2O、NaCl、FeCl3五种物质,图中相连的两种物质均可归属为一类,相交部分A、B、C、D为其相应的分类依据代号.请回答下列问题:
(1)请将分类依据代号填入相应的括号内:
①( )两种物质都不是电解质②( )两种物质都是钠的化合物
③( )两种物质都是氧化物④( )两种物质都是盐
(2)用洁净的烧杯取少量蒸馏水,用酒精灯加热至沸腾,向烧杯中逐滴加入1 mol/L的如图中某种物质M的水溶液,继续煮沸可制得一种红褐色胶体.
①物质M的化学式为________________.
②证明有红褐色胶体生成的实验原理是_____________________________________