实验室用图示装置制备KClO溶液,再与KOH、Fe(NO3)3溶液反应制备高效净水剂K2FeO4。
【查阅资料】Cl2与KOH溶液在20℃以下反应生成KClO,在较高温度下则生成KClO3;K2FeO4易溶于水、微溶于浓KOH溶液,在0℃~5℃的强碱性溶液中较稳定。
【制备KClO及K2FeO4】
(1)仪器a的名称: ,装置C中三颈瓶置于冰水浴中的目的是 。
(2)装置B吸收的气体是 ,装置D的作用是 。
(3)C中得到足量KClO后,将三颈瓶上的导管取下,依次加入KOH溶液、Fe(NO3)3溶液,水浴控制反应温度为25℃,搅拌1.5 h,溶液变为紫红色(含K2FeO4),该反应的离子方程式为 。再加入饱和KOH溶液,析出紫黑色晶体,过滤,得到K2FeO4粗产品。
(4)K2FeO4粗产品含有Fe(OH)3、KCl等杂质,其提纯步骤为:
①将一定量的K2FeO4粗产品溶于冷的3 mol/LKOH溶液中,② ,③ ,
④搅拌、静置、过滤,用乙醇洗涤2~3次,⑤在真空干燥箱中干燥。
【测定产品纯度】
(5)称取提纯后的K2FeO4样品0.2100 g于烧杯中,加入强碱性亚铬酸盐溶液,反应后再加稀硫酸调节溶液呈强酸性,配成250 mL溶液,取出25.00 mL放入锥形瓶,用0.01000 mol/L的(NH4)2Fe(SO4)2溶液滴定至终点,重复操作2次,平均消耗(NH4)2Fe(SO4)2溶液30.00 mL。涉及主要反应为:Cr(OH)4-+FeO42-==Fe(OH)3↓+CrO42-+OH-,Cr2O42-+6Fe2++14H+==6Fe3++2Cr3++7H2O,则该K2FeO4样品的纯度为 。
用18mol/L 浓硫酸配制100ml 3.0mol/L 稀硫酸的实验步骤如下:①计算所用浓硫酸的体积,②量取一定体积的浓硫酸,③溶解,④转移、洗涤,⑤定容、摇匀。回答下列问题:
(1)所需浓硫酸的体积是(保留到小数点后一位),量取浓硫酸所用的量筒的规格是(从下列中选:A. 10ml B. 25ml C. 50ml D. 100ml)
(2)在上述实验步骤中,需要用到玻璃棒的有(填序号)。
(3)第⑤步实验的操作是:继续向容量瓶注入蒸馏水至离刻度线1-2cm处,改用胶头滴管向容量瓶滴加至为止。塞紧瓶塞,倒转摇匀。
(4)下列情况对所配制的稀硫酸浓度有何影响?(填“偏大”、“偏小”或“无影响”)
A. 容量瓶用蒸馏水洗涤后残留有少量的水
B. 所用过的烧杯、玻璃棒未洗涤
(本小题共12分
 )某化学兴趣小组的同学利用下图所示实验装置进行实验(图中a、b、c表示止水夹).
)某化学兴趣小组的同学利用下图所示实验装置进行实验(图中a、b、c表示止水夹).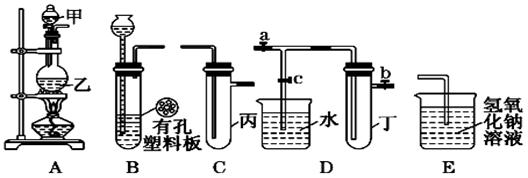
请按要求填空:
(1)利用B装置可制取的气体有______________________(写出两种即可).
(2)A、C、E相连后的装置可用于制取Cl2并进行相关的性质实验.
若在丙中加入适量水,即可制得氯水.将所得氯水分为两份,进行Ⅰ、Ⅱ两个实
验,实验操作、现象、结论如下:
| 实验序号 |
实验操作 |
现象 |
结论 |
| Ⅰ |
将氯水滴入品红溶液 |
溶液褪色 |
氯气与水反应的产物有漂白性 |
| Ⅱ |
氯水中加入碳酸氢钠粉末 |
 有无色气泡产生 有无色气泡产生 |
氯气与水反应的产物具有酸性 |
请你评价实验Ⅰ、Ⅱ的结论是否合理?若不合理,请说明理由________________
____________________________________________________________________.
(3)B、D、E装置相连后,在B中盛装浓硝酸和铜片(放在有孔塑料板上),可制得并进行NO2有关实验.
①B中发生反应的化学方程式为________________________________ ______
______
②欲用D装置验证NO2与水的反应,其操作步骤为:先关闭止水夹___________,再打开止水夹_________,使烧杯中的水进入试管丁的操作__________________
____________________________________________________________________.
③试管丁中的NO2与水充分反应后,若向试管内缓缓通入一定量的氧气,直到试管全部充满水,则所得溶液中溶质的物质的量浓度是______________________(气体按标准状况计算).
(10分)某校化学实验兴趣小组为了探究在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时证明氯气的某些性质,甲同学设计了如图所示的实验装置(支撑用的铁架台省略),按要求回答问题.
(1)若用含有0.2 mol HCl的浓盐酸与足量的MnO2反应制Cl2,制得的Cl2体积(标准状况下)总是小于1.12 L的原因是___________________________________________.
(2)①装置B中盛放的试剂名称为________,作用是____________________________,
现象是____________________________________________________________.
②装置 D和E中出现的不同现象说明的问题是_________________________________
D和E中出现的不同现象说明的问题是_________________________________
③装置F的作用是________________________________________________________.
④写出装置G中发生反应的离子方程式______________________________________
(3)乙同学认为甲同学的实验有缺陷,不能确保最终通入AgNO3溶液中的气体只有一种.为了确保实验结论的可靠性,证明最终通入AgNO3溶液的气体只有一种,乙同学提出在某两个装置之间再加一个装置.你认为该装置应加在________与________之间(填装置字母序号),装置中应放入________(填写试剂或用品名称).
如图所示,把试管放人盛有25℃饱和石灰水的烧杯中,试管中开始放入固体试剂A,再在试管中用滴管滴入5 mL液体试剂B。可见到烧杯中饱和的澄清石灰水变浑浊。试回答下列问题:
(1)试推测试剂A和B各是什么?(不一定填满,最(最少2组)
| 固体试剂A |
液体试剂B |
|
| ① |
||
| ② |
||
| ③ |
||
| ④ |
(2)解释烧杯中澄清石灰水变浑浊的原因:。
实验室用如图所示装置制取并收集NO,请回答下列问题: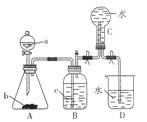
(1)仪器a的名称是。
(2)写出A中反应的化学方程式,其中HNO3表现的性质是,当有4molHNO3被还原时该反应中转移电子总数为。
(3)装置B的作用是
;
(4)A中产生的现象有。