Fe和Mg与H2SO4反应的实验如下:
| 实验 |
 |
 |
 |
 |
| 现象 |
Fe表面产生大量无色气泡 |
Fe表面产生气泡后迅速停止 |
Mg表面迅速产生大量气泡 |
Fe表面有大量气泡,Mg表面有少量气泡 |
关于上述实验说法不合理的是
A. I中产生气体的原因是:Fe + 2H+=Fe2++ H2↑
B. 取出Ⅱ中的铁棒放入CuSO4溶液立即析出亮红色固体
C. Ⅲ中现象说明Mg在浓H2SO4中没被钝化
D.Ⅳ中现象说明Mg的金属性比Fe强
用NA为阿伏加德罗常数的值,下列叙述中正确的是
| A.25℃时,pH=13的1.0LBa(OH)2溶液中含有的OH-数目为0.1NA |
| B.标准状况下,2.24L乙烷含有的化学键总数为0.8NA |
| C.常温下,23gNO2和N2O4的混合气体中含有的氮原子数为0.5 NA |
| D.标准状况下,22.4L甲醇中含有的氧原子数为NA |
加入铝粉能放出H2的溶液中肯定不能大量共存的离子组是
A. Fe3+、NO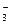 、Cl-、NH
、Cl-、NH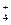 B.Ba2+、Mg2+、NO
B.Ba2+、Mg2+、NO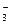 、Cl-
、Cl-
C.SO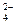 、Cl-、K+、NH
、Cl-、K+、NH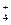 D.SO
D.SO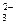 、K+、AlO
、K+、AlO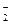 、Na+
、Na+
2008年诺贝尔化学奖授予美籍华裔钱永健等三位科学家,以表彰他们发现和研究了绿色荧光蛋白。荧光素是发光物质的基质,5-羧基荧光素(5-FAM)
结构简式如右图所示,在碱性条件下有强烈的绿色荧光,广泛
应用于荧光分析等。下列有关5-FAM说法不正确的是
| A.可与碳酸氢钠溶液反应 |
| B.分子式为C21H12O7 |
| C.1mol 该物质与足量NaOH溶液反应,可消耗4 mol氢氧化钠 |
| D.不与FeCl3发生反应 |
实验室有一瓶久置的白色粉末,元素分析证明它由钾、硫、氧三种元素组成,钾和硫的
质量比为39∶16,下列结论正确的是
| A.根据元素分析结果推测该粉末为纯净物 |
| B.将粉末溶于水,加入氯化钡,观察到有白色沉淀生成,证明原粉末是硫酸钾 |
| C.将粉末加入盐酸中,产生气泡,证明原粉末是亚硫酸钾 |
| D.将粉末溶于水,加入氯化钡和盐酸,观察到有白色沉淀和气泡生成,原粉末可能是硫酸钾和亚硫酸钾的混合物 |
如下图所示,a、b是两根石墨棒,下列叙述错误的是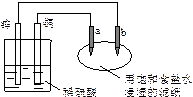
| A.往滤纸上滴加酚酞试液,a极附近颜色变红 |
| B.锌电极上的反应:Zn-2e→Zn2+ |
| C.稀硫酸中硫酸根离子的物质的量不变 |
| D.a是阳极,发生氧化反应 |